2024년 Nature:Engineered receptors for soluble cellular communication and disease sensing
페이지 정보
작성자 PnH 조회15회 작성일 25-02-05 13:20본문
David Baker 팀은 샌프란시스코 캘리포니아 대학의 Kole T. Roybal 팀과 협력하여 Nature 저널에 Engineered Receptors for soluble 세포 의사소통 및 질병 감지 라는 제목의 연구 논문을 발표했습니다 .
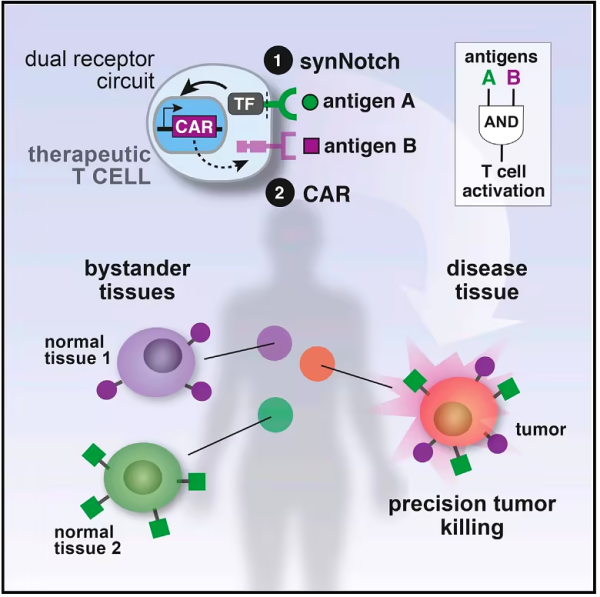
이 연구에서는 주변 환경의 분자를 감지하고 이에 따라 세포의 발현을 변경할 수 있는 고도로 맞춤화 가능한 조작된 수용체인 합성 막내 단백질 분해 수용체(SNIPR)를 개발했습니다. 이 수용체를 기반으로 구축된 CAR-T 세포는 특정 환경(예: 종양 근처)에서만 활성화될 수 있으므로 On-Target Off-Tumor를 줄일 수 있습니다.
종양 모델 실험에서는 SNIPR-CAR-T 세포가 건강한 조직에 미치는 영향을 최소화하고 CAR-T 세포 치료의 일반적인 부작용 없이 종양을 특이적으로 표적으로 삼고 크게 축소시키는 것으로 나타났습니다.
연구팀은 이번 연구가 종양 에 대한 정확한 전달을 통해 세포치료제의 효과를 높이고 부작용을 줄이는 암치료제 개발로 이어질 수 있으며, 자가면역 질환 등 암 이외의 다른 질환에도 혜택을 가져올 수 있다고 밝혔습니다 .
최근 몇 년간 포유류 합성 생물학의 상당한 진전에도 불구하고 가용성 리간드에 안정적으로 반응하고 이후 특정 세포 기능을 활성화할 수 있는 모듈형 합성 수용체는 여전히 부족합니다.
이 수용체는 조작된 세포 치료법의 활성을 조절하는 데 광범위한 임상적 잠재력을 가지고 있지만, 현재까지 이미 시판되고 있는 세포 치료법과 임상 시험에 들어가는 것은 종양 세포 표면에 위치한 표적만을 대상으로 합니다 .
2016년 초 Kole T. Roybal은 Cell 저널에 제1저자로 논문을 게재하여 새로운 유형의 센서-synNotch 수용체를 개발했습니다. 이 수용체는 T 세포 표면에 통합되어 종양 세포를 식별하고 면역을 활성화할 수 있습니다. 응답. 그러나 이 조작된 수용체는 종양 세포 표면의 리간드만 인식할 수 있으며 세포 간의 긴밀한 물리적 접촉에 의존하여 기능합니다.
종양 세포는 건강한 세포에서 진화하므로 종양 세포 표면의 단백질은 종종 건강한 세포 표면에도 존재합니다. 이것이 세포 표면 단백질에 의해서만 활성화될 수 있는 수용체가 실제 적용에 매우 제한적인 이유입니다. 실제로 종양에 의해 생성된 다른 많은 분자는 종양 환경을 식별하는 데 더 유용할 수 있습니다.
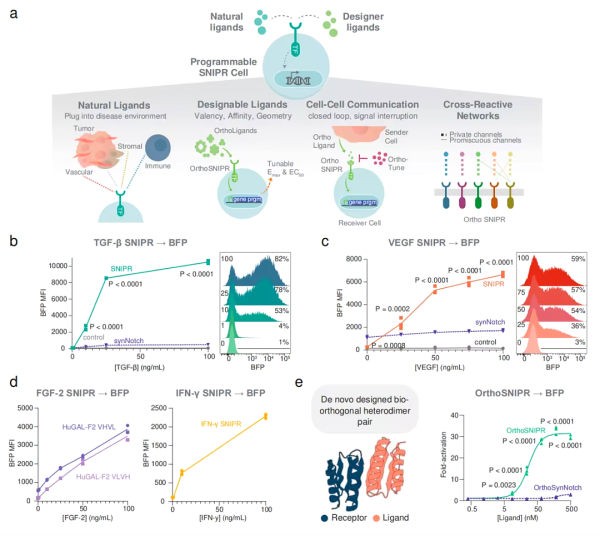
SynNotch 수용체를 개발한 후 Kole T. Roybal은 synNotch 수용체를 업그레이드하는 연구를 진행해 왔습니다. 이로 인해 그들은 궁극적으로 새로운 조작된 수용체인 합성 막내 단백질 분해 수용체(SNIPR)를 개발하게 되었습니다. SNIPR은 세포 표면 리간드뿐만 아니라 가용성 리간드에 의해서도 활성화될 수 있으므로 수용성 또는 자유 분자를 감지하고 결합할 수 있습니다. 종양 환경의 면역 신호 분자와 같은 세포 주변 환경. 이러한 분자가 해당 SNIPR에 결합하면 여러 수용체가 세포 내부에서 조립되어 뒤집혀 세포 내 DNA와 직접 상호 작용하여 유전자 발현을 변경합니다. 또한, 한 세포에 여러 개의 SNIPR을 발현시키면 서로 다른 유전자를 조절하거나 동일한 유전자를 서로 다른 방식으로 조절할 수 있습니다. 따라서 유전자 활동은 켜지거나 꺼지거나 조절될 수 있습니다.
최근 몇 년간 키메라 항원 수용체 T 세포(CAR-T) 치료법은 혈액 종양에 인상적이고 강력한 효과를 나타냈습니다. 이 치료법에는 일반적으로 암 환자의 T 세포를 유전적으로 조작한 다음 이를 환자의 체내에 다시 주입하는 것이 포함됩니다. 암세포를 인식하고 공격할 수 있게 해줍니다 . 그러나 CAR-T 세포 치료법은 암 유형과 수의 대부분을 차지하는 고형 종양에서는 덜 성공적이었습니다. 부분적으로 고형 종양 세포에는 T 세포가 인식할 수 있는 종양 특이적 항원이 부족하기 때문입니다.
이번 최신 연구에서 연구팀은 새로 설계된 SNIPR을 CAR-T 세포에 통합했습니다( 바이러스 벡터 사용으로 인해 발생할 수 있는 위험을 줄이기 위해 전기천공을 통해 게놈의 특정 위치에 통합).
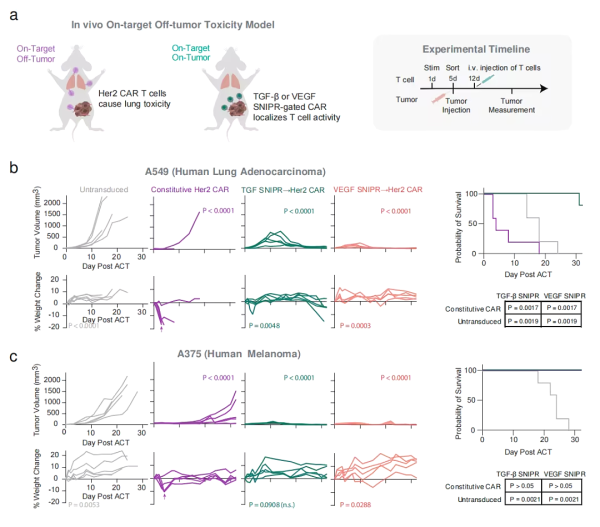
시험관 내 실험에서는 SNIPR이 TGF-β 및 VEGF가 있는 경우에만 CAR-T 세포의 항종양 활성을 시작하는 것으로 나타났습니다. 따라서 이러한 CAR-T 세포는 암의 영향을 받지 않는 신체 부위에서는 면역 반응을 시작하지 않습니다. 따라서 비종양 표적 독성을 감소시킵니다(On-Target Off-Tumor).
다음으로 연구팀은 인간 종양이 있는 쥐에서 SNIPR-CAR-T 세포가 CAR-T 세포 치료의 일반적인 부작용(예: 체중 감소, 장기 손상)을 일으키지 않고 종양을 특이적으로 표적으로 삼아 공격할 수 있다는 생체 내 검증을 수행했습니다. , 종양을 크게 줄이고 건강한 조직의 손상을 최소화합니다.
논문의 공동 교신저자이자 2024년 노벨 화학상 수상자인 데이비드 베이커(David Baker) 교수는 이것이 면역요법에 대한 이중 검증을 제공한다고 말했습니다. 첫째, 면역 세포는 특정 환경(예: 종양 주변)에 있어야 합니다. 그런 다음 면역 세포가 암세포를 식별하고 공격합니다.
확장된 플랫폼인 SNIPR은 다양한 천연 또는 합성 리간드(테더링 또는 용해성)와 상호 작용하여 기초 연구 및 질병 치료를 위한 세포의 정확한 조절을 달성할 수 있습니다. SNIPR의 다재다능한 특성은 현재의 세포 치료법을 개선하여 잠재적으로 보다 안전한 세포 치료법을 가능하게 하고 잠재적으로 자가면역 질환을 치료할 수 있는 강력한 도구가 됩니다.
연구팀은 여러 세포 유형에서 SNIPR을 사용하여 서로 다른 세포 유형 간의 통신을 중재하는 방법을 계속 연구하고 있는 것으로 알려졌습니다. 또한 콜 T. 로이발(Kole T. Roybal)이 공동 창업한 아스날 바이오(Arsenal Bio)는 CAR-T 세포 임상시험에서 해당 기술을 검증하고 있습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.