2022년 12월 Cell 연구 발표
페이지 정보
작성자 PnH 조회142회 작성일 24-05-26 14:46본문
1. Cell: 인간 샤페론 TRiC 유도 튜불린 폴딩 메커니즘 규명
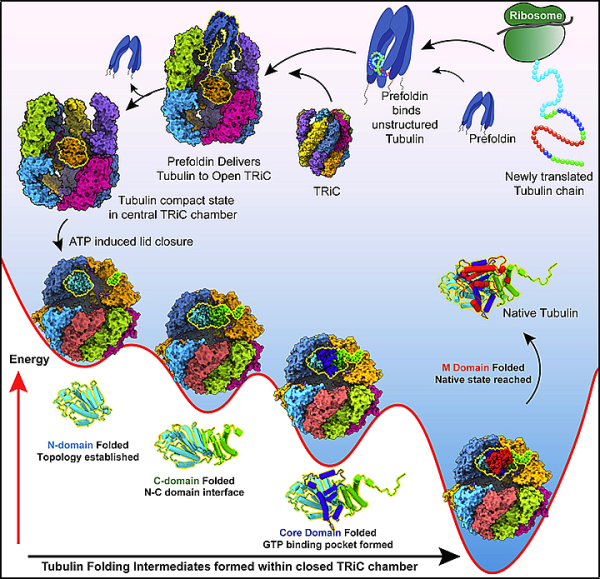
인간 튜불린은 세포 발판 및 수송 시스템 역할을 하는 미세소관의 구성 요소입니다. 획기적인 10년 연구에서 미국 에너지부의 SLAC 국립 가속기 연구소와 스탠포드 대학의 연구원들은 TRiC이라는 작은 세포 기계가 어떻게 튜불린 접힘을 지시하는지 밝혀냈습니다. 해당 연구 결과는 2022년 12월 8일 학술지 Cell에 "Structural Visualization of the tubulin folding pathwaydirected by human chaperonin TRiC/CCT"라는 논문 제목으로 게재되었습니다.
저자는 cryo-EM을 사용하여 거의 원자 분해능으로 TRiC 유도 단백질 접힘의 4가지 뚜렷한 단계를 포착하고 생화학적 및 생물물리학적 분석을 통해 본 것을 확인했습니다.
Frydman은 가장 기본적인 수준에서 이 연구가 TRiC의 도움 없이 튜불린이 접힐 수 없는 이유에 대한 오랜 미스터리를 해결했다고 말했습니다. ."
TRiC 챔버는 2개의 적층 고리를 형성하는 8개의 개별 서브유닛으로 구성되어 있다는 점에서 독특합니다. 가느다란 튜불린 사슬은 해파리 모양의 보조 분자에 의해 TRiC 챔버의 입구로 공급됩니다. 그런 다음 TRiC 챔버의 뚜껑이 닫히고 튜불린 폴딩이 시작됩니다. 이 접힘이 완료되면 뚜껑이 열리고 접힌 tubulin이 TRiC 챔버에서 나옵니다.
튜불린은 TRiC 없이는 접힐 수 없기 때문에 TRiC는 단순히 수동적으로 튜불린이 자발적으로 접히는 것을 돕는 것이 아닌 것으로 보입니다. 그러나 이것이 정확히 어떻게 작동합니까? 새로운 연구는 그 질문에 답하고 적어도 튜불린과 같은 단백질의 경우 "자발적 접힘"의 개념이 유지되지 않는다는 것을 보여줍니다. 대신 TRiC는 폴딩 경로를 직접 조정하여 단백질의 올바른 모양을 만듭니다.
2. Cell: 인간의 건강한 뇌가 노화 및 인지 장애 동안의 뇌척수액과 면역 조절 장애를 밝힌 새로운 연구
3파운드의 뇌가 무겁게 느껴지지 않는 이유는 뇌와 척수 주위를 흐르는 뇌척수액(CSF) 저장소에 떠 있기 때문입니다. 뇌와 두개골 사이의 이 유체 장벽은 머리 충격으로부터 뇌를 보호하고 뇌에 영양분을 공급합니다. 그러나 CSF에는 잘 알려지지는 않았지만 또 다른 기능이 있습니다. 뇌에 대한 면역 보호 기능도 제공합니다. 그러나 이 기능은 완전히 연구되지 않았습니다.
새로운 연구에서 Northwestern University의 Feinberg School of Medicine의 연구원들은 알츠하이머병과 같은 인지 장애에서 뇌척수액의 역할을 발견했습니다. 이 발견은 신경 퇴행성 과정에 새로운 빛을 비춰줍니다. 관련 연구 결과는 2022년 12월 13일 학술지 Cell에 온라인 게재될 예정이다. 논문 제목은 "건강한 뇌 노화 및 인지 장애 시 뇌척수액 면역 조절 장애"이다. 논문의 교신저자는 노스웨스턴 대학교 파인버그 의과대학의 신경과 조교수인 데이비드 게이트 박사입니다.
이 연구는 사람들이 나이가 들면서 뇌척수액 면역 체계가 조절되지 않는다는 것을 발견했습니다. 이 연구는 또한 알츠하이머병 환자와 같은 인지 장애가 있는 사람의 경우 이 뇌척수액 면역 체계가 건강한 사람의 면역 체계와 매우 다르다는 것을 발견했습니다.
Gate는 "이제 우리는 이 뇌의 면역 체계가 어떻게 건강한 노화 및 신경 퇴행과 관련되는지 이해할 수 있습니다. 뇌척수액 저장고로 알려진 이 면역 저장고는 잠재적으로 뇌 염증을 치료하거나 진단을 결정하는 데 사용될 수 있습니다. 치매 환자의 뇌 염증 수준 " . 우리는 건강한 뇌와 병든 뇌의 중요한 면역 레퍼토리에 대한 포괄적인 분석을 수행했습니다." 그의 팀은 데이터를 공개적으로 공유하고 있으며 그 결과는 온라인에서 검색할 수 있습니다.
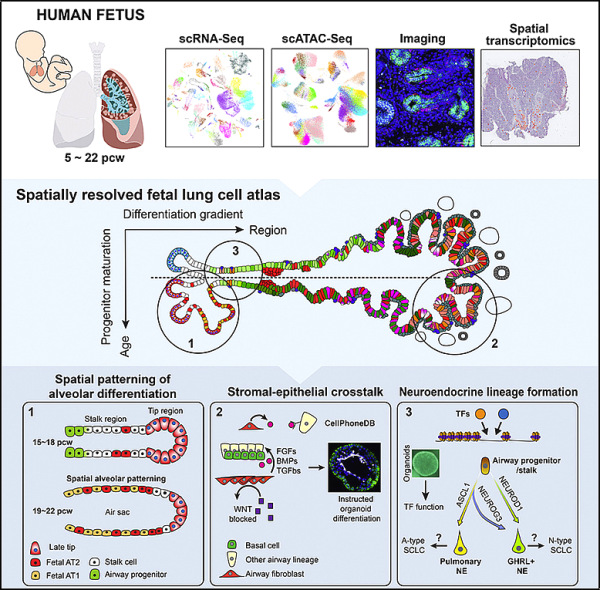
3. Cell: 인간 폐의 초기 단계에서 144개의 세포 유형을 발견한 새로운 연구
새로운 연구에서 영국의 Wellcome Trust Bioinformatics 발달 세포와 폐암 사이의 새로운 연관성을 밝힙니다. 그들은 한 번에 한 세포씩 폐 발달의 여러 단계에서 어떤 유전자가 활성화되는지 연구했습니다. 공간적 기술을 결합하여 발달 중인 폐에서 세포의 위치를 정확히 찾아 이 호흡 시스템이 어떻게 형성되는지 보여주는 발달 폐 세포 지도를 구성했습니다. 해당 연구 결과는 2022년 12월 8일 Cell 저널에 게재되었습니다. 논문 제목은 "A human fetal lung cell atlas, proximal-distal gradients of differentiations and key regulators of epithelial fates"입니다.
발달 중인 폐의 이 세포 아틀라스를 구성하기 위해 저자는 초기 세포의 단일 세포 시퀀싱을 공간 기술과 결합하여 폐 발달에 대한 심층 데이터 세트를 구성했습니다. 이 공개 리소스는 발달 중인 폐 구조에 어떤 세포 유형이 존재하고 이러한 세포가 어떻게 조절되는지 설명합니다.
저자는 나중에 발생하는 인간 소세포 폐암과 관련될 수 있는 하위 유형을 포함하여 중간 및 중간 세포 유형과 같은 144개의 세포 유형을 확인했습니다.
그들은 이 셀룰러 아틀라스를 사용하여 폐 세포가 어떻게 발달하는지, 특히 어떤 유전자가 이 과정을 주도하는 핵심 역할을 하는지 예측했습니다. 그런 다음 오가노이드 모델을 사용하여 새로운 가설을 테스트하여 이 세포 아틀라스가 조직 발달과 관련된 단계와 세포를 정확하게 예측하는 데 사용될 수 있음을 입증했습니다.
4. Cell: 수천 종의 바이러스에서 발견되는 CRISPR-Cas 시스템 세포 게놈 편집 개선 기대
바이러스 게놈의 체계적인 스캔은 잠재적인 CRISPR 기반 게놈 편집 도구의 풍부함을 보여줍니다. CRISPR-Cas 시스템은 박테리아와 고세균의 미생물 세계에서 흔히 볼 수 있으며, 종종 호스트 세포가 바이러스로부터 자신을 방어하도록 돕습니다. 그러나 새로운 연구에서 UCLA의 연구원들은 CRISPR-Cas 시스템이 박테리오파지라고 불리는 이러한 미생물을 감염시키는 바이러스의 공개적으로 이용 가능한 게놈 서열의 0.4%를 차지한다는 것을 발견했습니다. 그들은 이 바이러스들이 CRISPR-Cas를 사용하여 서로 경쟁하고 숙주의 유전자 활동을 유리하게 조작할 수 있다고 제안합니다. 해당 연구 결과는 2022년 11월 23일 학술지 Cell에 "Diverse virus-encoded CRISPR-Cas systems include Streamlined genome editors"라는 논문 제목으로 게재되었습니다.
새로운 연구에서 UC 버클리 분자생물학자인 Jennifer Doudna와 미생물학자인 Jillian Banfield와 동료들은 박테리아와 고세균을 감염시키는 바이러스(파지-Cas 시스템)에서 CRISPR을 보다 완전하게 찾기로 결정했습니다. 놀랍게도 그들은 알려진 모든 유형의 CRISPR-Cas 시스템의 대표자를 포함하여 CRISPR-Cas 시스템을 암호화하는 약 6,000개의 파지를 발견했습니다. "이러한 CRISPR-Cas 시스템이 파지에 유용한 시스템이라는 증거가 있습니다."라고 Doudna는 말했습니다.
저자는 일반적인 CRISPR-Cas 구조에서 일부 CRISPR-Cas 시스템에는 구성 요소가 누락되고 다른 시스템은 비정상적으로 컴팩트한 광범위한 변형을 발견했습니다. "파지 암호화 CRISPR-Cas 시스템이 드물더라도 매우 다양하고 널리 퍼져 있습니다. 자연은 놀라움으로 가득 차 있습니다."라고 프랑스 국립 과학 연구 센터에서 파지 생태와 진화를 연구하는 Anne Chevallereau는 말합니다.
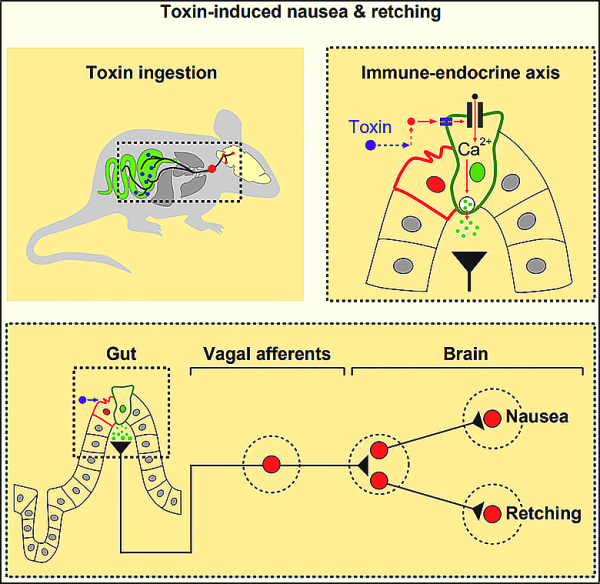
5. Cell: 중국 과학자들은 감염된 음식을 먹은 후 구토의 신경 경로를 밝힙니다.
오염된 음식을 먹은 후 토하고 싶은 충동은 박테리아 독소를 제거하기 위한 신체의 자연 방어 반응입니다. 그러나 우리의 뇌가 세균을 감지한 후 이러한 생물학적 반응을 시작하는 방법은 여전히 파악하기 어렵습니다. 새로운 연구에서 중국 베이징 생물학 연구소, 칭화 대학교, 광저우 의과 대학교, 중국 과학 기술 대학교, 수도 의과 대학교, 푸단 대학교의 연구원들은 쥐의 장에서 뇌까지의 방어 반응을 처음으로 매핑했습니다. 시간 상세한 신경 경로. 이 발견은 과학자들이 화학 요법을 받는 암 환자를 위한 더 나은 항오심제를 개발하는 데 도움이 될 수 있습니다. 관련 연구 결과는 2022년 11월 10일 학술지 Cell에 "The gut-to-brain axis for toxin-induced defensor Responses"라는 논문 제목으로 게재되었습니다.
공동 교신 저자인 베이징 생물 과학 연구소의 Peng Cao 박사와 그의 팀은 쥐가 토하지 않는 동안 구역질을 한다는 사실을 발견했습니다. 뱉어. 연구팀은 마우스가 인간에게 식인성 질병을 유발하는 황색포도상구균이 생산하는 일반적인 박테리아 독소인 SEA(Staphylococcal enterotoxin A)를 투여받은 후 비정상적으로 입을 벌리는 것을 발견했습니다.
SEA를 받은 쥐는 식염수를 받은 대조군 쥐에서 관찰된 것보다 더 넓은 각도로 입을 벌렸습니다. 또한, SEA 처리된 쥐의 횡경막 근육과 복근은 입을 벌리는 동안 동시에 수축했으며, 이는 개가 구토할 때 관찰되는 패턴입니다. 정상적인 호흡 중에는 동물의 횡격막과 복근이 교대로 수축합니다.
Cao는 "구역질의 신경 메커니즘은 구토와 유사하다. 이번 실험에서 우리는 독소에 대한 뇌의 방어 반응을 연구하기 위해 마우스에서 독소 유발 구역질을 연구하는 모델을 성공적으로 확립했다"고 말했다.
6. Cell: 30년의 미스터리가 드디어 풀렸다! WNK는 상 분리를 사용하여 스트레스를 받은 세포에서 자체 부피를 복원함을 밝혔습니다.
새로운 연구에서 University of Pittsburgh와 Carnegie Mellon University의 연구원들은 현미경으로 스트레스를 받는 세포의 사이키델릭한 비디오를 촬영하여 미스터리를 풀기 위한 여정을 시작했습니다. 그들의 연구는 과학자들이 30년 전에 처음 제안된 수수께끼의 점들을 연결하기 위해 약간의 우연을 어떻게 사용했는지 설명합니다. 관련 연구 결과는 2022년 10월 31일 Cell 저널에 온라인 게재될 예정입니다. 논문 제목은 "WNK kinases sense molecular crowding and rescue cell volume via phase separation"입니다.
공동 제1 저자인 Carnegie Mellon University의 박사후 연구원인 Daniel Shiwarski 박사와 이 논문의 공동 제1 저자인 Cary Boyd-Shiwarski 박사는 우연한 실험이 어떻게 우연한 발견으로 바뀌었는지 설명합니다. "저희는 이번 연구와 관련 없는 in vivo 형광 이미징 실험을 하고 있었는데, 세포에 식염수를 첨가하자 세포질 내부의 내용물이 순식간에 형광 용암 램프로 변했습니다.
세포가 갑자기 고농도의 염분이나 설탕과 같은 외부 스트레스 요인에 노출되면 크기가 줄어듭니다. 1990년대 초에 과학자들은 세포 내에서 단백질 농도 또는 "밀집"을 어떻게든 모니터링함으로써 세포가 부피를 회복한다고 제안했습니다. 그러나 그들은 세포가 과밀하다고 느끼는 방식을 알지 못했습니다. 그러다가 2000년대 초반에 WNK(With-No-Lysine kinase)라는 계열이 발견되었습니다. 수년 동안 과학자들은 WNK가 세포 수축을 역전시킨다고 추측해 왔지만 그렇게 하는 방법 또한 미스터리였습니다.
새로운 연구는 WNK 키나아제가 상분리라고 불리는 과정을 통해 세포 부피가 평형 상태로 돌아가도록 하는 "스위치"를 활성화하는 방법을 밝히면서 두 퍼즐을 모두 해결했습니다. "세포 내부에는 여러 분자가 완벽하게 혼합된 용액에 떠 있는 분산형으로 일반적으로 생각되는 세포질이 포함되어 있습니다. 그러나 세포질이 작동하는 방식에 대해 생각하는 방식에 놀라운 변화가 있습니다. 작고 작은 단백질 덩어리와 작은 물방울, 그리고 과밀과 같은 것이 흥분되면 현미경으로 볼 수 있는 큰 물방울로 합쳐집니다."
이 액체와 같은 물방울은 Shiwarski와 Boyd-Shiwarski가 실험실에서 세포에 소금 용액을 추가했을 때 "라바 램프"로 본 것입니다. 그들은 WNK1에 형광 태그를 부착하여 세포질 전체에 확산되어 전체 세포가 빛나게 했습니다. 이 염 용액을 첨가하면 WNK1이 서로 뭉쳐서 용암 램프의 점액처럼 세포를 통해 스며 나오는 거대한 네온 녹색 소구를 형성합니다. 그들은 WNK1이 세포에서 염 수송체 SLC12를 활성화시키는 분자와 함께 액적으로 응축될 때 상 분리로 본 것을 설명합니다. 이 단계를 통해 셀에 이온과 물을 동시에 입력할 수 있어 셀의 부피가 몇 초 내에 원래 상태로 돌아갈 수 있습니다.
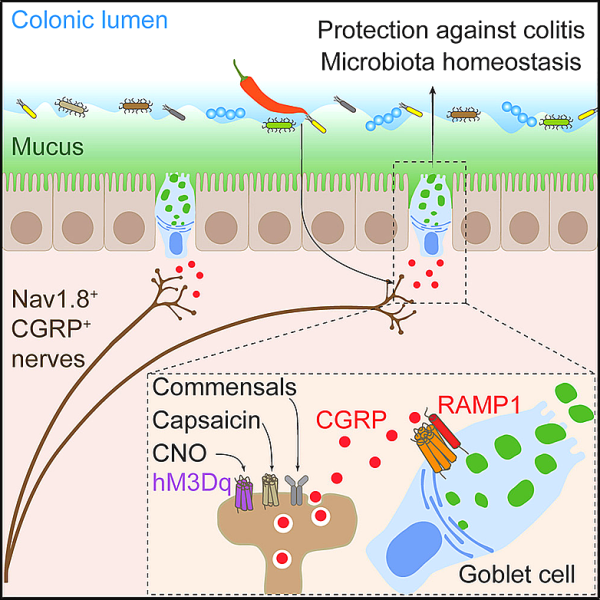
7. Cell: 소화기관의 통증 뉴런은 소화관 염증으로부터 더 많은 보호 점액을 방출하도록 세포를 촉진합니다.
통증은 부상의 존재를 감지하고 신체에 문제가 있다는 신호를 보내는 진화의 가장 신뢰할 수 있는 도구 중 하나로 오랫동안 생각되어 왔습니다. 그러나 고통이 단순한 깨우기 이상의 것이라면 어떨까요? 고통 자체가 보호의 한 형태라면 어떨까요?
새로운 연구에서 미국 하버드 의과대학, 시카고 대학, 스웨덴 예테보리 대학의 연구원들은 생쥐에서 이것이 사실일 수 있다고 제안합니다. 그들은 생쥐의 내장에 있는 통증 뉴런(통각수용기 뉴런)이 정상적인 조건에서 보호 점액의 존재를 조절하고 염증 조건에서 더 많은 점액을 방출하도록 장 세포를 자극한다는 것을 발견했습니다. 관련 연구 결과는 2022년 10월 14일 학술지 Cell에 온라인으로 게재될 예정입니다. 논문 제목은 "통각수용체 뉴런이 CGRP-RAMP1 축을 통해 술잔 세포를 유도하여 점액 생성 및 장 장벽 보호를 유도합니다"입니다.
새로운 연구는 통증 뉴런이 점액을 포함하는 내장 세포와 직접 소통한다는 것을 보여주는 복잡한 신호 캐스케이드의 단계를 자세히 설명합니다. 교신저자인 하버드 의대 블라바트니크 연구소 면역생물학 부교수 아이작 치우(Isaac Chiu)는 "통증이 잠재적인 피해를 감지하고 뇌에 신호를 보내는 전통적인 방식보다 더 직접적인 방식으로 우리를 보호할 수 있다는 것이 밝혀졌다"고 말했습니다. 우리의 연구는 장의 통증 매개 뉴런이 근처의 장 상피 세포와 어떻게 대화하는지 보여줍니다. 이것은 장에서 신경계의 주요 역할이 우리에게 불쾌한 감각을 주는 것이 아니라 장이라는 것을 의미합니다. 그리고 염증 동안 보호 메커니즘입니다."
8. Cell: 최초로 구축된 진균 미생물 지도
새로운 연구에서 샌디에고 캘리포니아 대학교와 이스라엘 와이즈만 과학 연구소를 포함한 기관의 연구원들은 35가지 유형의 암과 관련 곰팡이를 조사하여 최초의 범암 진균 미생물군집 지도를 구성했습니다. 관련 연구 결과는 2022년 9월 29일 학술지 셀(Cell)에 "Pan-cancer analysiss revise cancer-type-specific fungalecologies and bacteriome interaction" 논문 제목으로 게재됐다.
새로운 연구는 35개의 암에 걸쳐 4개의 독립적인 코호트에서 얻은 17,401명의 환자 조직, 혈액 및 혈장 샘플에서 암 진균 마이크로바이옴(암과 관련된 진균)을 특성화했습니다. 이 저자들은 많은 주요 인간 암에서 진균 DNA와 세포가 적고 암 유형에 따라 커뮤니티 구성의 차이가 다르다는 것을 발견했습니다.
곰팡이 군집을 일치하는 박테롬(마이크로바이옴의 박테리아 부분) 및 면역체(면역 체계를 구성하는 유전자 및 단백질)와 비교한 분석에서는 이들이 경쟁보다는 서로 연관되는 경향이 있는 것으로 나타났습니다. 예를 들어, 한 곰팡이 종은 50세 이상 환자의 유방암 종양이 풍부한 것으로 밝혀진 반면 다른 곰팡이 종은 폐암 샘플에서 훨씬 더 풍부한 것으로 밝혀졌습니다.
특정 곰팡이와 연령, 종양 아형, 흡연 상태, 면역 요법에 대한 반응, 생존 측정 사이에는 명확한 연관성이 있다고 저자는 말했습니다. 이 균류가 단순히 관련이 있는지 또는 인과적으로 연결되어 있는지는 아직 결정되지 않았습니다.
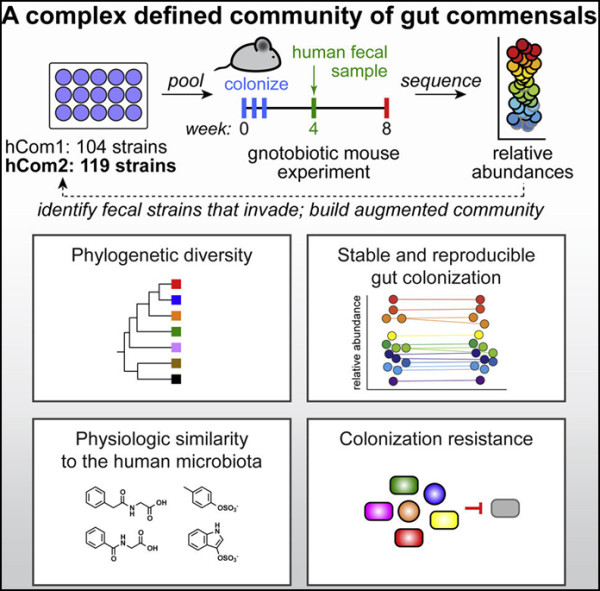
9. Cell: 100종 이상의 박테리아 종으로 구성된 합성 장내 마이크로바이옴을 성공적으로 구축했으며, 다양한 질병을 치료하기 위한 마이크로바이옴 치료법을 개발할 것으로 예상됩니다.
지난 10년 동안의 중추적 연구에 따르면 인간의 소화 시스템 그러나 이러한 개체군은 복잡하고 구성 요소를 연구하는 체계적인 방법이 없으면 일부 질병과 관련된 정확한 세포와 분자는 수수께끼로 남아 있습니다.
새로운 연구에서 스탠포드 대학의 연구원들은 가장 복잡하고 잘 정의된 합성 마이크로바이옴(synthetic microbiome)을 확립하고 100종 이상의 박테리아 종으로 구성된 박테리아 커뮤니티를 구축했으며 성공적으로 마우스에 이식했습니다. 개별 박테리아 종을 추가, 제거 및 편집할 수 있는 능력을 통해 과학자들은 미생물군집과 건강 사이의 연관성을 더 잘 이해하고 궁극적으로 동급 최강의 미생물군집 치료제를 개발할 수 있습니다.
관련 연구 결과는 2022년 9월 6일 Cell 저널에 온라인 게재될 예정입니다.
논문 제목은 "Design, construction, and in vivo Augmentation of a complex gut microbiome"입니다.
스탠포드 대학의 공동교신저자 Michael Fischbach는 마이크로바이옴을 처음부터 구축하는 이러한 접근 방식이 언젠가는 마이크로바이옴 기반의 공학적 치료법을 가능하게 할 것이라고 생각합니다. Stanford의 Microbiome Therapies Initiative(MITI)의 책임자로서 그의 목표는 언젠가 다양한 질병을 치료하거나 예방하기 위해 인간에게 이식할 수 있는 조작된 박테리아 공동체를 만드는 것입니다.
10. Cell: 뉴런의 새로운 형태의 시냅스 발견
새로운 연구에서 Howard Hughes Medical Institute의 Janelia Research Campus 연구원들은 뉴런 표면의 1차 섬모에서 새로운 유형의 시냅스를 발견했습니다. 관련 연구 결과는 2022년 9월 1일 학술지 Cell에 "A serotonergic axon-cilium synapse drives nuclear signaling to alter chromatinaccessibility"라는 논문 제목으로 게재되었습니다.
저자는 섬모를 잘 살펴보기 위해 FIB-SEM(집속 이온 빔 주사 전자 현미경)을 사용했습니다. 이 고성능 현미경을 통해 뉴런의 축삭과 세포체 외부로 튀어나온 섬모 사이의 시냅스라는 연결을 볼 수 있었습니다. 이러한 연결의 구조적 특징은 알려진 시냅스에서 발견되는 것과 유사하여 이러한 연결을 "축삭 섬모(축삭 섬모라고도 함)" 시냅스라고 부릅니다.
그들은 어떻게 신경전달물질인 세로토닌(세로토닌이라고도 함)이 축삭에서 섬모의 수용체로 방출되는지 단계별로 보여줄 수 있었습니다. 이것은 염색질 구조를 열고 핵의 게놈에 변화를 허용하는 신호 캐스케이드를 시작합니다. Sheu는 "함수는 정적 구조를 변경합니다. 구조 발견에 대한 확신이 생기면 그 기능적 특성을 자세히 분석했습니다."라고 말했습니다.
11. Cell: SP140 발현 억제로 크론병 치료 기대
Speckled Protein 140(SP140)이라는 염색질 리더 단백질의 돌연변이는 염증성 장 질환의 일종인 크론병을 비롯한 특정 면역 질환의 위험 증가와 관련이 있습니다. 새로운 연구에서 매사추세츠 종합병원(MGH)과 하버드 의과대학을 포함한 기관의 연구원들은 잠재적인 치료 목표를 가리키는 이 링크의 메커니즘에 대한 새로운 통찰력을 제공합니다. 관련 연구 결과는 2022년 8월 18일자 Cell에 게재되었습니다. 논문 제목은 "Epigenetic reader SP140 loss of function drives Crohn's disease due to uncontrolled macrophage topoisomerases"입니다.