2023년 췌장암에 대한 연구 보고서
페이지 정보
작성자 PnH 조회105회 작성일 24-05-26 15:26본문
오늘날 췌장암은 여전히 전 세계 인구가 직면한 가장 치명적인 악성 종양 중 하나이며, 췌관 선암(PDAC) 환자의 5년 생존율이 약 3%에 불과하기 때문에 전 세계적으로 PDAC에 대한 수술도 어렵습니다. 새로운 치료 전략을 개발하기 위해 연구자들은 분자 수준에서 PDAC의 생물학을 더 잘 이해할 필요가 있습니다.
최근 국제학술지 Cancer Science에 게재된 "Identification of a novel target of SETD1A histone methyltransferase and the clinical meaning in pancreatic cancer"라는 제목의 연구 보고서에서 Tokyo Medical and Dental University 및 기타 기관의 과학자들은 새로운 표적이 가능한 것을 확인했습니다 .
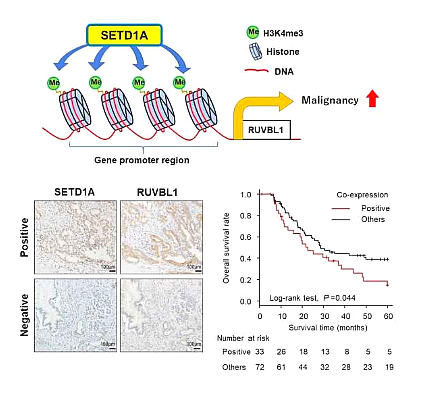
Cancer Science (2022) DOI: 10.1111/cas.15615
이전 연구에서는 암세포가 특정 효소인 히스톤 H3K4 메틸트랜스퍼라제(SETD1A 유전자에 의해 인코딩됨)를 높은 수준으로 발현하는 것으로 나타났으며, 이 효소는 특정 세포에 메틸화 과정이라고 하는데, 이 효소의 과발현을 유도하는 분자적으로 암세포에 미치는 영향에 대해서는 현재 연구가 진행되고 있는 바가 없습니다.
표적 유전자는 히스톤이 메틸화될 때 활성화되며, SETD1A가 암 발생 및 진행을 지원하는 유전자를 표적으로 한다면 특히 흥미롭기 때문에 연구자들은 SETD1A의 역할을 이해하는 데 관심이 있습니다. 과발현은 PDAC에서 중요한 역할을 합니다. Takeshi Ishii 연구원은 이전 연구에서 SETD1A가 다음과 같은 다양한 암에서 과발현되는 것으로 나타났지만 위암 및 폐암 등이 있지만 PDAC에서 특정 분자 이벤트를 알지 못하며 PDAC에서 SETD1A의 표적 유전자는 아직 결정 또는 확인되지 않았습니다.
[2] Nat Cancer: 면역 관문억제제 3종 복합제 투여로 췌장암 치료 기대
최근 미국 텍사스대 MD앤더슨암연구소 연구팀은 "Targeting T cell checkpoints 41BB and LAG3 and myeloid cell CXCR1/CXCR2 results in antitumor immune and Durable response in pancreatic cancer"라는 제목의 연구보고서를 국제학술지 Nature Cancer에 게재했다. 센터는 T 세포와 골수 억제 세포의 면역 체크포인트를 표적으로 하고 종양 면역 미세 환경을 성공적으로 재프로그래밍하며 췌장암의 전임상 모델에서 항종양 반응을 크게 개선하는 세 가지 면역 요법의 새로운 조합을 발견 했습니다 .
새로운 연구에서 저자는 실험쥐 및 췌장암에서 포괄적인 면역 프로파일링을 사용하여 면역 요법 내성의 메커니즘을 체계적으로 식별하고 잠재적인 치료 표적을 조사했습니다. 그들은 종양 면역 미세 환경을 중화시키는 몇 가지 다른 면역 억제 메커니즘이 실험실 모델에서 극적으로 생존율을 향상시켜 이 극도로 치명적이고 반응이 없는 암에 대한 잠재적인 치료 옵션을 가리키는 것을 발견했습니다. 연구원인 Ronald DePinho 박사는 "이 삼중 면역 요법에서 전례 없는 치유 반응을 가져왔습니다."라고 말했습니다. 췌장암은 면역요법에 취약하다는 견해가 지배적이지만, 이번 전임상 연구를 통해 췌장암도 적절한 치료법 조합에 취약할 수 있음을 보입니다. 또한, 췌장암 샘플에 이러한 표적이 존재한다는 사실은 이 치료 조합이 언젠가 환자를 도울 수 있다는 흥미로운 가능성을 높입니다.
췌장암은 미국에서 암 사망의 주요 원인 중 하나이며, 부분적으로는 사례의 80%가 진행된 단계에서 진단 되기 때문입니다 . 췌장암은 또한 일반적으로 사용되는 항-PD-1 및 항-CTLA-4 면역 체크포인트 억제제에 반응하지 않는다는 의미인 "비 면역원성"으로 간주됩니다. 이것은 부분적으로 종양 면역 미세 환경의 면역 억제 상태 때문이지만 이 저항성의 기전은 완전히 이해되지 않았습니다. 이 저자들은 종양 면역 미세 환경이 여러 면역 요법에 의해 어떻게 영향을 받는지 조사하기 위해 고차원 면역 프로파일링 및 단일 세포 RNA 시퀀싱을 사용했습니다. 그들은 소진된 T 세포에서 높게 발현되는 특정 면역 체크포인트 단백질(41BB 및 LAG)을 확인했습니다.
【3】 과학자들은 췌장암 세포를 죽이기 위해 T 세포를 사용할 것으로 예상됩니다.
많은 고형암은 면역억제성 미세환경이 T세포의 침투, 활성화, 증식을 차단하기 때문에 T세포 치료에 반응하지 않는데, 최근 국제학술지 사이언스에 "T세포를 유도하는 합성 사이토카인 회로"라는 제목의 논문이 발표됐습니다. 제외된 종양" 연구에서 샌프란시스코 캘리포니아 대학교 및 기타 기관의 과학자들은 T 세포가 강력한 암과 싸우는 인자를 생성하도록 공학적으로 연구했지만 종양 세포와 마주쳤을 때만 가능했습니다. 흑색종과 췌장암을 제거한 면역 요법은 치료하기 어려운 암과 싸우기 위한 잠재적인 새로운 전략을 제공할 수 있습니다.
이 세포는 암 세포를 죽이고 감염으로부터 신체를 보호하는 특화된 세포인 T 세포의 기능을 향상시키는 신체의 면역 체계에 의해 자연적으로 생성되는 강력한 염증 분자인 IL-2를 생성합니다. IL-2는 잠재적인 항암 활성을 가지고 있으며 전신 투여 시 독성으로 인해 종종 사용이 제한되었습니다. 이 연구에서 연구자들은 종양 침윤 T 세포가 암세포를 인식할 때 자체 IL-2를 생성하도록 프로그래밍하여 암 내에 포함된 사이토카인을 유지했습니다. 연구원인 Wendell Lim 박사는 "우리는 이러한 세포가 국소 전달 인자로 작용할 수 있는 능력을 이용했으며 금은 T 세포가 올바른 위치에 있다는 것을 인식할 때만 T 세포의 확장자 역할을 활성화합니다."라고 말했습니다. 세포 요법을 사용하여 여러 강력하지만 독성이 있는 치료제를 보다 표적화된 방식으로 전달할 수 있습니다.
세포치료는 혈액암의 암세포가 자유롭게 떠다니며 쉽게 구할 수 있기 때문에 많은 혈액암 치료에 매우 효과적이지만, 고형암은 치료용 T세포가 자신에게 침입하는 것을 막기 위해 여러 개의 방어벽을 구축하게 되며, 만약 세포는 종양에 들어갈 수 없으며 종종 암세포를 파괴하기 전에 소진됩니다. 종양학자들은 1980년대부터 고용량의 IL-2가 T 세포를 촉진하여 이러한 장벽을 극복하고 사이토카인이 이러한 암 사례에 도전하는 새로운 암 치료법으로도 작용한다는 사실을 알고 있었습니다. 고열, 혈관 누출 및 장기 부전. 연구원인 Lim 등은 세포를 조작하여 IL-2의 효과를 억제하여 이러한 세포가 필요한 경우(종양에서)에만 항암 면역 반응을 강화하는 것을 목표로 했습니다.
【4】 매트릭스 메탈로프로테이나제에 의해 절단되는 제1형 콜라겐의 췌장암 성장 촉진 메커니즘 규명
췌관 선암종(PDAC)은 가장 흔하고 치명적인 형태의 췌장암입니다. PDAC 환자의 전체 5년 생존율은 7.1%에 불과합니다. PDAC의 독특한 특징은 섬유아세포 및 이들이 분비하는 세포외 매트릭스에 의한 종양 덩어리의 침윤으로 인해 종양 내에서 광범위한 데스모플라시아(desmoplasia)입니다. 세포외기질의 주성분은 Type I 콜라겐(Col 1)으로 인체에 널리 존재하는 단백질로 뼈, 피부, 혈관, 결합조직의 기본 구조를 형성합니다. PDAC 생산과 치료에 대한 반응에 대한 Col 1의 효과는 과학자들 사이에서 격렬한 논쟁의 대상이 되어 왔습니다. 일부는 Col 1이 종양 성장 및 확산을 촉진한다고 믿는 반면, 다른 일부는 Col 1이 종양 성장을 제한하고 암 세포에 대한 면역을 보호한다고 믿습니다.
최근 국제학술지 네이처(Nature)에 게재된 "콜라게노리시스-의존적 DDR1 시그널링이 췌장암 결과를 지시한다"는 제목의 연구 보고서에서 난징대학교 의과대학 부설 병원 및 기타 기관의 과학자들이 연구를 통해 이 논란을 해법을 제시한했습니다. 중요한 것은 종양에 있는 Col 1의 양이 아니라 그 품질과 특성입니다. 구체적으로, 그들은 매트릭스 메탈로프로테이나제(콜라겐과 같은 매트릭스 단백질을 분해하는 효소)에 의해 절단된 Col 1이 종양 성장을 자극하는 반면, 온전하고 절단되지 않은 Col 1은 종양 성장을 억제한다고 보고합니다. "또한 절단된 Col 1은 DDR1이라는 수용체 단백질에 결합하여 췌장암 세포에서 에너지 생산을 자극하는 신호 경로를 활성화합니다."라고 Su는 말했습니다.
Uncleaved Col 1은 DDR1 신호 경로의 분해를 유도하여 이를 억제합니다.
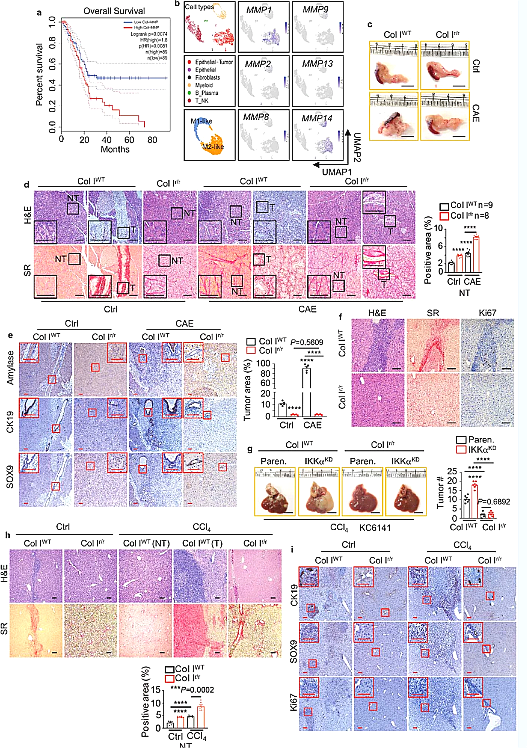
Nature , 2022, doi:10.1038/s41586-022-05169-z.
새로운 연구는 실험 모델과 용해되거나 용해되지 않은 Col 1을 포함하는 세포외 매트릭스에 PDAC 세포를 배치한 새로운 배양 시스템을 사용하여 수행되었습니다. 저자에 따르면 이번 발견은 중요한 임상적 의미를 갖습니다. 인간 PDAC 간질 또는 결합 조직에서 절단된 Col 1과 절단되지 않은 Col 1의 상대적인 양은 외과적 절제 후 환자의 생존에 큰 영향을 미칩니다. 종양에 절단된 Col 1이 풍부하고 암세포가 높은 수준의 DDR1을 발현하는 환자는 예후가 좋지 않았으며 대부분 수술 후 2년 이내에 질병으로 사망했습니다. 이 예후가 좋지 않은 환자 그룹은 Sun 박사와 동료들이 제공한 암 표본을 사용하여 연구에서 분석된 106명의 환자 중 75%를 차지했습니다.
[5] 소분자 억제제를 사용한 STAT3의 선택적 표적화는 췌장암 치료를 위한 잠재적인 전략입니다.
STAT3(Signal Transducer and activator of transcription 3)는 STAT 계열의 단백질에 속하는 잠재적인 세포질 전사 인자입니다. 사이토카인, 성장 인자 및 기타 신호의 자극 하에 STAT3는 구성적으로 활성화되어 종양 세포의 생존, 성장, 이동, 약물 내성 및 면역 회피를 지원합니다. STAT3 신호 전달 경로의 활성화는 질병 진행 및 불량한 예후와 밀접한 관련이 있으므로 STAT3는 종양 치료의 중요한 표적입니다. 최근 화동사범대학 연구진은 Clin Cancer Res 저널에 "소분자 억제제를 사용하여 STAT3를 선택적으로 표적화하는 것이 췌장암에 대한 잠재적인 치료 전략"이라는 제목의 기사를 게재하여 1급 선택성 STAT3 억제제 WB436B의 잠재력을 입증했습니다.
췌장암은 모든 인간 암 중에서 가장 예후가 좋지 않으며 효과적인 새로운 치료법이 시급히 필요합니다. STAT3(Signal Transducer and activator of transcription 3)는 췌장암 치료의 유망한 표적인 것으로 나타났습니다. 그러나 작은 분자로 STAT3를 선택적으로 표적화하는 것은 어려운 문제로 남아 있습니다. 연구원들은 STAT3 억제제의 특이성을 결정하기 위해 구조 기반 가상 스크리닝 및 직접 결합 실험을 통해 130만 개 이상의 화합물을 스크리닝했습니다. WB436B의 결합 아미노산은 유도 FIT 분자 접합 및 , Rosetta 리간드 계산 및 부위 지정 돌연변이 유발에 의해 확인되었습니다.
[6] 관해를 위한 췌관 선암종에 숨은 분자 메커니즘 밝히기
췌장암의 가장 흔한 형태인 종양세포는 생존과 성장을 위해 영양분을 공유할 수 있으며, 최근 국제학술지 (Nature Cancer 에 "Differential integrated stress response and asparagine production drive symbiosis and therapy resistance of pancreatic adenocarcinoma cells"라는 제목의 논문이 실렸습니다. 캘리포니아 대학을 포함한 기관의 과학자들이 4년 동안 연구한 결과 모든 췌장암의 90% 이상을 차지하는 췌관 선암종에 대한 더 나은 치료법을 개발하는 데 도움이 될 수 있다고 보고서는 말했습니다 .
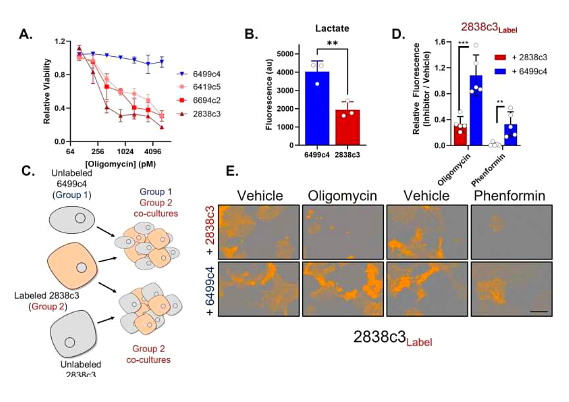
Nature Cancer (2022) DOI: 10.1038/s43018-022-00463-1
현재 췌관 선암종을 치료할 때 과학자들이 직면하고 있는 문제 중 하나는 일반적으로 초기 증상을 나타내지 않는다는 것이며 또 다른 장애물은 치밀하고 섬유성 종양의 복잡성으로 인해 종양에 완전히 존재하지 않는다는 것입니다. 과학자들이 화학 요법을 효과적으로 사용하는 것을 매우 어렵게 만들지만 종양이 다른 대사 패턴을 발달시킬 것이라는 의미이기도 합니다. 크리스토퍼 할브룩(Christopher Halbrook) 연구원은 혈관이 없으면 췌관 선암종 세포가 필요한 정상적인 영양을 얻을 수 없기 때문에 스스로 영양을 공급하고 성장할 수 있는 다른 많은 방법을 생각해 낼 것이라고 말했습니다. 암 대사에 영향을 미치는 것이 중요합니다.
연구원들은 종양에서 두 가지 유형의 췌관 선암종 세포를 발견했으며, 각각은 영양소를 교환하여 서로 필요한 것을 얻을 수 있도록 하는 다른 대사 과정을 가지고 있습니다. 연구원들은 한 유형의 암세포가 매우 민감하다는 것을 발견했습니다. 암 치료에 흔히 사용되는 미토콘드리아의 "독"에 대한 것이지만, 다른 유형의 세포에서 얻은 아스파라긴산이라는 아미노산은 지속적인 스트레스에 반응하여 아스파라긴산염을 과잉 생산하기 때문에 공유할 것이 많은 세포의 도움으로 세포가 생존할 수 있습니다.
【7】 새로운 유형의 항-KARS 약물이 인간 췌관 선암종 치료에 기대될 수 있습니다
KRAS 발암 유전자 돌연변이는 췌관 선암종(PDAC) 환자의 90% 이상에서 존재하며, 그 중 Gly에서 Asp로의 돌연변이(KRASG12D)가 가장 흔합니다. 최근 미국 펜실베이니아대 등의 과학자들은 국제학술지인 Cancer Discovery에 게재된 "Efficacy of a small molecule inhibitor of KrasG12D in immunocompetent models of pancreatic cancer"라는 제목의 연구보고서에서 Small-molecule 은 공격이 어렵다는 사실을 발견했다. 인간 암의 거의 30%에 존재하는 발암성 돌연변이 KRAS의 억제제는 췌장암의 전임상 모델에서 성공적으로 종양 축소를 촉진하고 암 성장을 차단할 수 있으며 후기 단계 과학자들의 임상 시험을 위한 강력한 후보가 될 수 있습니다.
연구원인 Ben Stanger 박사는 지난 10년 동안 테스트된 이 유형의 암에 대한 전임상 연구 모델에서도 이전에 췌장암 연구에서 관찰한 것과 완전히 대조되는 결과라고 말했습니다. 새로운 면역 요법을 포함하여 영향이 제한적이었습니다. 췌장암 환자의 전반적인 예후는 좋지 않으며 5년 생존율은 11%에 불과하고 치료는 종종 매우 제한적입니다. 췌장암의 거의 90%는 인간 암의 가장 흔한 유형인 KRAS의 돌연변이로 인해 발생합니다 oncogene은 KRAS G12C 변이가 있는 비소세포폐암 환자의 치료를 위해 지난해 최초의 KRAS 표적 치료제로 승인됐으나 췌장암의 2%만이 이 변이를 발현하고, KRAS를 가진 환자의 약 36%가 변이를 보였다. 췌장암은 모두 KRAS G12D 변이형이었습니다.
이번 연구에서 연구원들은 KRAS G12D를 구체적으로 표적으로 삼기 위해 미라티 테라퓨틱스에서 개발한 MRTX1133 저분자 억제제를 사용했으며, 지난 달 네이처 메디신(Nature Medicine) 저널에 논문을 게재했다. KRAS 억제제는 암세포를 직접 표적으로 삼을 뿐만 아니라 예기치 않게 신체의 면역 체계와 상호 작용하여 오래 지속되는 치료 반응을 생성하는데, 이는 암이 결국 대부분의 표적 치료를 회피할 수 있는 방법을 찾게 될 것이기 때문에 매우 중요합니다.
【8】 KRAS 유발 췌관 선암종에서 특수 사이토카인의 핵심 역할 규명
최근 국제 저널인 Advanced Science에 게재된 "PPDPF는 SOS1의 GEF 활동을 조절함으로써 돌연변이 KRAS-Driven 췌장관 선암종의 발달을 촉진합니다"라는 제목의 연구 보고서에서 Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences 및 다른 기관 과학자들은 췌관 선암종의 발달에서 췌관 그룹 세포 분화 및 증식 인자(PPDPF)의 핵심 역할을 밝히고 췌관 선암종의 치료를 위한 잠재적인 치료 전략도 제안했습니다.
췌관 선암종은 전 세계적으로 암으로 인한 사망의 6번째 주요 원인입니다.췌장암 환자의 5년 전체 생존율은 5% 미만입니다.췌관 선암종의 최대 98%는 KRAS 돌연변이를 가지고 있습니다.SOS1 퓨린 뉴클레오타이드와 같은 RAS 조류 교환인자(GEF)는 원형질막에 모집되어 RAS에서 GDP와 GTP의 교환을 촉매하여 EGFR이 활성화될 때 신호의 발현을 켭니다.이전 연구에서는 GEF가 GTP에 결합할 수 있음을 보여주었습니다.그러나, 연구 GTP 결합이 GEF에 얼마나 중요한지 그리고 SOS1이 GTP에 결합할 수 있는지 여부는 불분명합니다.
제브라피쉬에서 최초로 보고된 PPDPF는 잠재적인 PDZ, SH2, SH3 도메인 결합 부위뿐만 아니라 GTP 결합 부위를 포함하는 외분비 세포 조절인자이지만, 췌장암에서 PPDPF의 생물학적 기능은 연구원들에게 알려지지 않았습니다. 이 연구에서 연구자들은 PPDPF의 발현이 췌장암에서 증가하고 PPDPF 발현 수준이 높은 환자는 예후가 더 좋지 않은 경향이 있음을 발견했습니다. 종양의 발달을 상당히 억제합니다.
[10] 종양 마이크로바이옴의 상호 작용은 췌장암에 대한 새로운 치료법을 식별하는 데 도움이 될 수 있습니다.
미생물은 불임으로 추정되는 기관을 포함하여 다양한 암 유형에서 검출되었지만 인간의 발암 및 항종양 반응에 미치는 영향은 불분명합니다. 최근 국제저널 Cancer Cell에 게재된 "Tumor microbiome Links cellular programs and Immunity in pancreatic cancer"라는 제목의 연구 보고서에서 미국 Rutgers University 및 기타 기관의 과학자들은 연구를 통해 췌장 종양의 microbiome을 분석한 특징과, 염증 및 환자 생존과 관련될 수 있는 단일 세포 분해능에서 특정 미생물을 확인했습니다.
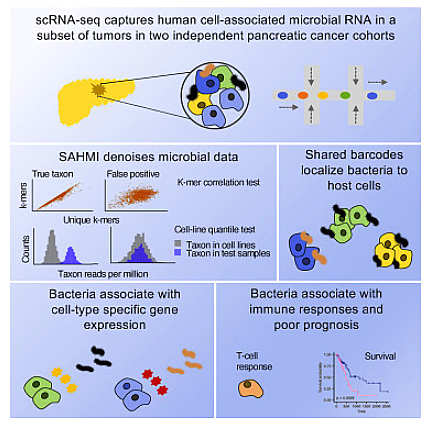
Cancer Cell (2022) DOI: 10.1016/j.ccell.2022.09.009
연구원에 따르면, 이 미생물은 미국 인구에서 암 관련 사망의 네 번째 주요 원인인 췌장암의 조기 진단 및 치료를 위한 새로운 표적이 될 수 있습니다. 미생물은 육안으로 볼 수 없는 아주 작은 유기체로 우리 몸에는 인간 세포의 총 수보다 더 많은 미생물이 살고 있으며, 예전에는 췌장과 같은 기관에도 그에 상응하는 미생물이 존재한다고 생각한 적이 있습니다. Subhajyoti De 연구원은 "이번 연구에서 우리는 특정 미생물이 췌장 종양에 서식하는지 여부와 이들이 암 진행 및 치료에 영향을 미치는지 더 깊이 파고들기 시작했습니다. 그리고 미생물 발자국이 너무 작기 때문에 종종 안정적으로 감지할 수 없습니다.
더 자세히 조사하기 위해 연구원들은 SAHMI(Single-cell analysis of Host-Microbiome Interactions)라는 게놈 접근 방식을 개발하여 단일 인간 세포와 관련된 미생물을 식별했습니다. 유전자는 인간을 나타낼 가능성이 있으며 미생물 기원입니다. 드 연구원은 이번 신기술을 통해 종양 관련 미생물을 식별함과 동시에 숙주세포의 활성도를 측정할 수 있게 됐다며 이는 획기적인 기술 발전으로 그 결과가 놀랍다고 말했습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.










