2024년 ADC 이중항체 또는 항체 약물 연구 발표
페이지 정보
작성자 PnH 조회49회 작성일 25-02-05 13:57본문
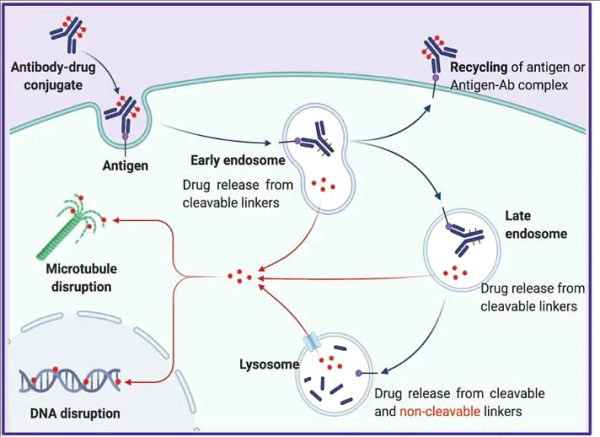
항체약물접합체( ADC )는 항체 약물의 정확한 표적화와 소분자 세포독성 약물의 효율적인 사멸이라는 장점을 결합한 복합 약물입니다. ADC는 단일클론 항체의 강력한 표적화와 소분자 독소의 높은 활성이라는 장점을 결합하여 소분자 세포독소의 독성 부작용을 줄일 수 있을 뿐만 아니라 약물 효능도 향상시킬 수 있습니다. 암 분야에서의 위상이 높아지고 있습니다.
초기 ADC 약물은 강력한 면역원성, 불충분한 독성 부하 효능, 불안정한 링커 등의 문제에 직면했습니다. 이후 신제품은 DAR 값 및 페이로드 등 여러 측면에서 최적화되었습니다. 기술이 발전하면서 ADC 시장은 2020년부터 폭발적인 시기를 맞이했고, 집중적인 임상 레이아웃과 제품 승인을 통해 수확기를 맞이했습니다.
Trop2 ADC 약물 루칸사르투주맙(Rukansartuzumab)이 삼중음성유방암(TNBC) 치료제로 NMPA 승인을 받았습니다 . 국내 최초로 생산된 TROP2 ADC가 중국에서 승인됐습니다. 또한 상장 승인을 완전히 받은 중국 최초의 국내 ADC이기도 합니다. 같은 날화동의약의 엽산 수용체 α(FRα)를 표적으로 하는 최초의 ADC 약물인 소미툭시맙(somituximab)도 이전에 치료를 받은 적이 있는 FRα 양성, 백금 기반 환자의 치료를 위해 NMPA의 승인을 받았습니다. 1~3차 전신요법 약물저항성 상피난소암, 자궁암 또는 원발성 복막암이 있는 성인 환자를 대상으로 선 승인 받았습니다.
통계에 따르면 전 세계적으로 16개의 ADC가 승인되었으며, 그 중 9개는 적응증 측면에서 중국에서 시판용으로 승인되었으며, 그 중 6개는 혈액 종양이고 10개는 고형 종양입니다.
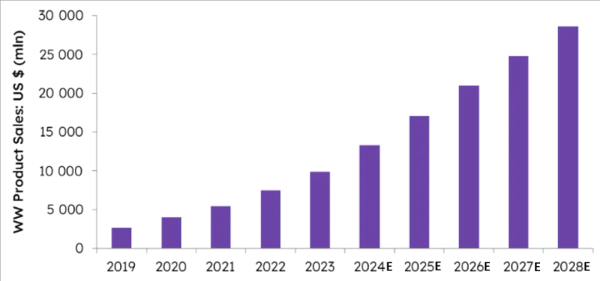
메디컬큐브 통계에 따르면 2020년부터 2022년까지 ADC 의약품 매출 증가율은 각각 50.66%, 34.23%, 43.88%로, 2022년 매출은 77억1900만달러에 달했습니다. 이 중 HER2를 표적으로 하는 2개 ADC 약물인 엔허투(Enhertu)와 캐싸일라(Kadcyla)는 시판 ADC 중 가장 높은 매출을 기록하며, 2023년 총 매출은 각각 24억5600만달러와 22억2000만달러에 달한다. Evaluate의 최신 보고서에 따르면 관련 ADC 약물 시장 규모는 2028년에 다시 3배 증가하여 약 300억 달러에 이를 것으로 예상됩니다.
Tairantuximab
트라스투주맙 듀오카마진 ( T-Duo )은 새로운 유형 의 HER2 표적 ADC 로 , 절단 가능한 링커인 트라스투주맙과 세포독성 페이로드 (dukamycin)로 구성되며 독특한 메커니즘을 통해 항종양 효과를 발휘할 수 있습니다. 이전에 치료받은 HER2 양성 전이성 유방암( MBC ) 환자를 대상으로 한 무작위, 국제, 다기관, 3상 TULIP 연구 에서 이전에 2회 이상의 HER2 표적 MBC 요법을 받은 환자 또는 T- HER2 양성 국소 진행성 유방암 환자 또는 DM1 으로 처리된 MBC는 T-Duo ( 1.2 mg/kg q3w ) 그룹과 PC 그룹에 2 : 1 의 할당 비율로 무작위로 할당되었습니다 . 연구의 1차 평가변수는 맹검 독립 중앙 검토를 통해 평가된 무진행 생존 기간이었습니다. 2차 평가변수에는 전체 생존율, 객관적 반응률, 안전성이 포함됩니다.
데이터 컷오프 시점에서 T-Duo 치료군 의 PFS는 7.0 개월 로 의사가 선택한 치료군의 4.9 개월보다 유의하게 좋았습니다 ( P=0.002 ). 전체 생존기간은 T-Duo 군에서 20.4 개월 , 의사선택군에서 16.3 개월로 나타났으나 이 차이는 통계적으로 유의하지 않았습니다. 객관적 반응률은 T-Duo 그룹 에서 27.8% , 의사 선택 그룹에서 29.5% 였습니다 . 이상반응 측면에서, 티-듀오 치료 환자의 78.1%가 1회 이상의 안구 독성 이상반응을 경험한 반면, 대조군 환자 의 29.2%는 이에 비해 더 높았습니다 . 3 등급 이상의 눈 독성 사례는 실험군 환자의 21.2% 에서 보고되었으며 대조군에서는 환자가 보고되지 않았습니다. 이는 특정 부작용에도 불구하고 무진행 생존율을 향상시키는 T-Duo 의 효과를 보여줍니다.
Vodutuximab
보두트라스투주맙( KL-A166 , A166 )은 높은 페이로드와 낮은 독성 DAR 설계를 채택하고 동일한 아미노산과 낮은 HER2 단클론 항체 접합에서 새로운 고세포독성 튜불린 억제제 듀오스타틴-5 와 안정적인 효소 절단 가능 링커를 결합 합니다 . trastuzumab과 같은 서열은 HER2 표적 의 효과적인 결합을 보장합니다 . 종양 세포에 대한 A166 독소 분자의 작용 메커니즘은 미세소관 억제입니다. 이는 미세소관을 억제하여 세포 분열 주기에 영향을 미치고, 이는 G2/M 단계 에서 세포 주기를 정지 시키고 세포 사멸을 유도합니다.
회사는 2023년 5월 진행성 HER2+ 유방암( 3L+ ) 치료를 위한 A166 에 대한 마케팅 신청서를 NMPA 에 제출 했으며 , 진행성 HER2+ BC 치료용으로 중국에서 승인된 최초의 국내 ADC 제품 중 하나가 될 것으로 예상됩니다 . 또한, 회사는 2023년 6월 에 진행성 HER2 + BC 환자를 위한 2차 이상 치료법으로 A166 대 T-DM1 의 확증적인 3상 시험을 시작할 예정입니다 . 이 연구는 HER2 양성 유방암 분야에서; , KL-A166 의 최적 용량 은 4.8mg/kg 이며 , 유효성 데이터는 KL-A166 ( 4 차 환자) vs DS-8201 ( 2 차 환자) vs RC-48 ( 3 차 환자): ORR ( 73.9% 대 NA 대 72.7% ), mPFS ( 1,230만 대 1,780만 대 NA ).
PatritumabDeruxtean
패트리투맙 데룩스테칸 (HER3-DXd)는 Daiichi Sankyo 기술을 사용하여 설계된 잠재적인 동급 최초의 HER3 표적 ADC 이며 Daiichi Sankyo와 Merck가 공동으로 개발하고 상용화했습니다. HER3-DXd는 2021년 12월 미국 FDA로부터 3 세대 티로신 키나제 억제제를 투여받고 있는 EGFR 변이 국소 진행성 또는 전이성 비소세포폐암( NSCLC ) 환자 치료를 위한 혁신 치료제로 지정되었습니다. 또는 ( TKI ) 및 백금 기반 약물 치료 후 . 중추적인 2 상 HERTHENA-Lung01 연구 결과에 따르면, EGFR TKI 와 백금 기반 화학요법 이후 질환이 진행된 EGFR 변이 국소 진행성 또는 전이성 비소세포 폐암 환자 225 명에서 파트리투맙 데룩스테칸 의 객관적 반응률( ORR )은 29.8% 였다 . 95%CI : 23.9-36.2 ), 완전 반응 1개와 부분 반응 66개 를 포함합니다 . 반응 기간 중앙값은 6.4 개월( 95% CI : 4.9-7.8 )이었습니다.
Datopotumab deruxtecan
Datopotumab deruxtecan( Dato - DXd )은 Daiichi Sankyo와 Merck가 공동 개발한 또 다른 TROP2 표적 ADC 입니다 . 약물의 항체 부분은 다중 토포이소머라제 I 억제제 페이로드(익소테칸 유도체)를 갖는 절단 가능한 테트라펩타이드 링커를 통해 인간화 항 -TROP2 IgG1 단일클론 항체( 삿포로 의과대학 과 공동 개발 )로 구성되며, DXd ) 연결로 구성됩니다.
무작위 공개 제 III 상 TROPION-Lung01 연구에서 이전에 치료받은 진행성 비교했습니다Dato-DXd환자를 대상으로(NSCLC)전이성 비소세포폐암/ PFS 중앙값은 4.4 였습니다 . Dato-DXd 그룹에서는 개월 , docetaxel 그룹 에서는 3.7 개월 ( P=0.004) ), 중앙 OS는 각각 12.9 개월과 11.8 개월 이었습니다 ( P = 0.530 ). 사전 지정된 비편평 조직학 하위군에서 PFS 중앙값은 5.5 개월 대 3.6 개월 이었고 OS 중앙값은 14.6 개월 대 12.3 개월 이었습니다 . 편평 조직학 하위 그룹에서 PFS 중앙값은 2.8 개월 대 3.9 개월 이었고 OS 중앙값 은 7.6 개월 대 9.4 개월 이었습니다 . Dato-DXd 및 도세탁셀 투여군에서 각각 25.6% 및 42.1% 의 환자에서 3 등급 이상의 치료 관련 이상반응이 발생했으며 , 모든 등급의 약물 관련 간질성 폐질환 / 폐렴을 경험한 환자는 8.8% 및 4.1% 였습니다 .
또한 TROPION-PanTumor02 연구 의 NSCLC 코호트 결과는 이전에 치료받은 진행성 또는 전이성 NSCLC를 앓는 중국 환자에서 Dato-DXd 단일 제제 의 효능과 안전성을 추가로 검증했습니다 . 그 결과, 2023년 10 월 9일 기준 평균 추적기간은 8.1 개월로 확인된 ORR 은 45.0% , 반응기간( DoR ) 중앙값 은 8.3 개월, 질병통제율( DCR )은 8.3개월로 나타났습니다. 85% . 무진행 생존율( PFS )은 7.4 개월이었습니다. 비편평 세포 암종 하위 그룹은 ORR이 최대 56.5% , PFS 중앙값 이 9.6 개월로 더욱 고무적인 항종양 활성과 생존 혜택을 보여주었습니다.
Ruikang Trastuzumab( SHR-A1811 )은 HER2를 표적으로 하는 ADC 약물로 종양 세포 표면의 HER2 에 특이적으로 결합할 수 있습니다 . 이어서 접합체는 세포 내로 유입되어 리소좀으로 운반되며, 유리 독소 SHR169265는 DNA 토포이소머라제 I 의 활성을 억제 하고 종양 세포의 세포사멸을 유도 할 수 있는 역할을 합니다 .
HER2를 과발현, 증폭 또는 돌연변이하는 진행성 NSCLC 환자의 안전성, 내약성, 약동학 및 효능에 대한 1 상 /2상 임상 연구 에서 전체 용량 그룹의 환자 중 무진행률 중앙값( mPFS )은 약 9.5 개월, 연구자 평가를 통해 확인한 객관적 반응률( ORR ) 은 38.1% , 질병통제율( DCR )은 90% 이상 으로 높으며 , 평균 반응기간( DoR )은 10.3 개월이다. 4.8mg/kg 용량군 의 PFS 중앙값 은 8.4 개월, 치료 후 40% 이상의 환자가 질병 완화에 도달했고, ORR은 41.9 % , DCR은 95.3 % , DoR 중앙값 은 13.7 개월 로, SHR - HER2 돌연변이 폐암 치료 에서 A1811 의 잠재력과 가치를 인정받았습니다 .
Verbecavirtuzumab
Verbecavirtuzumab( MRG003 ) 은 EGFR 표적화 단일 클론 항체와 강력한 미세소관 억제 페이로드 MMAE 분자가 vc 링커를 통해 결합되어 구성된 ADC 로 종양 표면의 EGFR 에 특이적으로 결합합니다 . 세포 내이입을 통해 종양 세포에 들어간 후 강력한 페이로드를 방출하여 종양 세포 사멸을 초래합니다. NPC 에 대한 2a 상 연구 에서 1차 평가변수는 RECIST 1.1 기준에 따라 평가된 ORR 이었고 2차 평가변수에는 DCR , DoR , PFS 및 안전성이 포함되었습니다. 그 결과, 2023년 3월 15일 현재 2.0mg / kg 용량 군 에서 총 28명의 환자를 평가할 수 있었으며 ORR 은 39.3% , DCR 은 71.4 % , mDoR 은 6.8 개월, mPFS 는 7.3 개월. 총 29명의 환자를 2.3mg/kg 용량군 에서 평가할 수 있었으며 , ORR 은 55.2% , DCR 은 86.2% , mDoR 은 6.8 개월, 미성숙 mPFS 였습니다 . 안전성 측면에서 가장 흔한 치료 관련 부작용( TRAE )에는 발진( 49.2% ), 소양증( 41.0% ), 빈혈( 34.4% ), 탈모증( 31.1% )이 포함되었으며 CTCAE 5.0 기준 에 따르면 대부분의 TRAE가 발생했습니다. 레벨 1 또는 2 였습니다 . 치료 관련 심각한 부작용( SAE ) 발생률은 11.5% ( 7/61 ) 였습니다 . TRAE 로 인한 용량 감소는 13.1% ( 8/61 ) 에서 발생했고 3명의 환자가 치료를 중단했습니다( 4.9% ). 치료와 관련된 사망은 관찰되지 않았습니다.
Telisotuzumab Vedotin
텔리소투주맙 베도틴 ( Teliso-V )은 c-Met를 표적으로 하는 ADC로 주로 비소세포폐암 (NSCLC) 치료에 사용합니다 . 이 약물은 발린 와E(MMAE)vcMMAE)–(ABT-700링커-시트룰린 항 -c-Met 인간화 단일 클론 항체 ABT-700 으로 구성됩니다. 결합을 통해 MMAE 를 종양 세포로 직접 전달하는 것을 중재합니다. 2 상 LUMINOSITY 연구에서는 국소 진행성 / 전이성 c-MetOE NSCLC 환자를 모집했습니다 . 그 결과 ORR은 c-Met 고발현 그룹 에서 34.6% , c-Met 중등도 발현 그룹 에서 22.9% , 전체 28.6% 인 것으로 나타났습니다. . DOR은 c-Met 고발현 그룹 에서 9.0 개월 , c-Met 중간발현 그룹 에서 7.2 개월 , 전체적으로 8.3 개월이었습니다. 가장 흔한 모든 등급의 치료 관련 부작용( TRAE )에는 말초 신경병증( 30% ), 말초 부종( 16% ) 및 피로( 14% )가 포함되었습니다. 5 등급 TRAE (간질성 폐질환, 호흡 부전)가 2명의 환자 에게서 발생했습니다 .
Kailaiying Pharmaceutical News, Love Medicine Time and Space, China Medical Tribune Today's Tumor, CPHI Pharmaceutical Online, Let's Talk About Blood
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.