2023년 Cell: 7월 저널 발표 (2)
페이지 정보
작성자 PnH 조회94회 작성일 24-05-30 15:08본문
1. Cell: 백신으로 T 세포 반응을 극대화해 고형 종양을 제거에 효과가 있습니다.
조작된 T 세포를 사용하여 암세포를 파괴하는 것은 백혈병 및 림프종 과 같은 특정 유형의 암을 치료하는 데 성공했습니다.
최근 국제학술지 셀(Cell)에 게재된 "Vaccine-boosted CAR T crosstalk with host immune to reject tumors with antigen heterogeneity"라는 제목의 연구 보고서에서 MIT 등의 과학자들은 이를 극복할 수 있는 방법을 발견했습니다. 키메라 항원 수용체(CAR) T 세포라고 하는 조작된 T 세포의 반응을 촉진하는 동시에 면역 체계가 다른 종양을 표적으로 삼는 새로운 T 세포를 생성하는 데 도움을 주는 백신입니다.
연구원 Darrell Irvine 교수는 강화된 백신이 항원 확산이라는 과정을 주도하는 것으로 보이며, 신체의 면역 체계가 조작된 CAR T 세포와 협력하여 항원을 거부한다고 말했습니다. . 현재 혈액암을 치료하기 위한 여러 FDA 승인 T 세포 요법이 있으며, 모두 암 세포에 존재하는 특정 항원을 인식하는 수용체를 표시하도록 조작할 수 있는 CAR-T 세포를 기반으로 합니다.
이 치료법을 뇌암의 일종인 교모세포종에 적용하기 위해 연구원들은 EGFR 수용체의 돌연변이 버전을 표적으로 하도록 CAR-T 세포를 조작했지만 모든 교모세포종 세포가 이 항원을 발현하는 것은 아니며 종양 세포가 이 항원을 발현하고 CAR-T 세포, 일부 교모세포종 세포는 표적 항원 생산을 중단함으로써 반응합니다. 2019년 연구에서 연구원 Irvine과 연구원들은 조작된 T 세포를 사용한 직후 실험에 직접 백신을 주입하여 교모세포종에 대한 CAR-T 세포의 효능을 강화했습니다. CAR-T 세포가 접촉하게 되는 림프절의 면역 세포에 의해 면역세포가 올라갑니다.
이 연구에서 연구원들은 백신에 대한 부스트가 조작된 CAR-T 세포가 종양을 공격하는 데 도움이 되었을 뿐만 아니라 다른 종양도 표적으로 삼는 데 도움이 될 수 있는 또 다른 예기치 않은 효과가 있음을 발견했습니다. "항원 확장"으로 알려진 이 현상은 함께 작용할 때 종양 질환을 완전히 근절하고 종양 재성장을 예방할 수 있는 T 세포의 특수 집단을 생성하기 때문에 바람직합니다. "그것은 고형 종양의 항원 이질성을 처리하는 데 도움이 될 수 있습니다. 숙주 T 세포가 다른 항원을 공격하면 CAR-T 세포가 죽일 수 없는 종양을 죽일 수 있기 때문입니다."라고 말했습니다.
2. Cell: TransitID를 사용하여 세포 내 및 세포 사이의 프로테옴을 활성화에 도움됩니다.
우리 DNA의 유전 프로그램은 우리 몸의 구조와 활동의 기초가 되는 단백질을 통해 기능을 수행합니다. 그러나 프로테옴(세포 또는 특정 영역 내의 모든 단백질)은 단백질 환경이 매우 복잡하기 때문에 비교적 미스터리로 남아 있습니다. 예를 들어 인간은 수만 개의 서로 다른 단백질을 만듭니다.
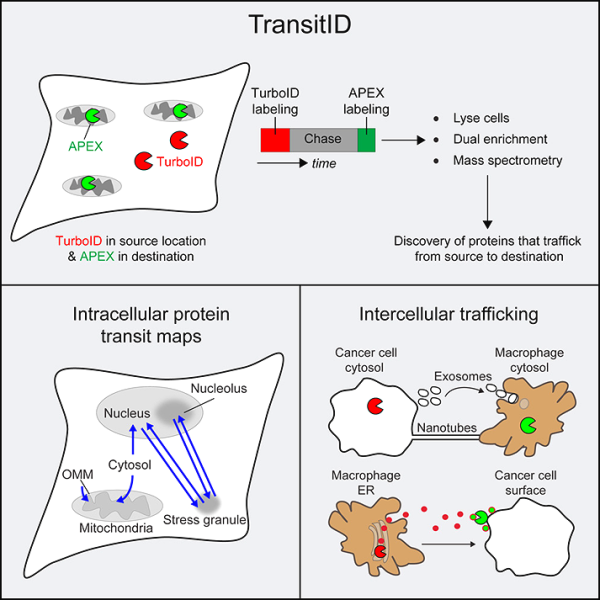
이러한 복잡성을 해독하는 데 도움을 주기 위해 새로운 연구에서 미국 스탠포드 대학의 연구원들은 살아있는 세포에서 단백질의 완전한 활동을 추적하는 TransitID라는 새로운 방법의 개발을 주도했습니다. 관련 연구 결과는 2023년 6월 28일 Cell 저널 온라인 게재 예정입니다. 논문 제목은 "Dynamic mapping of proteome traffic within and between living cells by TransitID"입니다.
2023, doi:10.1016/j.cell.2023.05.044
스탠포드 의과대학 유전학 교수이자 이 논문의 수석 저자인 Alice Ting은 "우리의 새로운 기술을 통해 사람들은 현미경과 질량 분석 프로테오믹스의 장점을 결합하여 살아 있는 샘플을 실제로 관찰할 수 있습니다. 움직이고 기능하며 편향되지 않은 방식으로 모든 단백질을 한 번에 볼 수 있습니다. 이전에는 이러한 장점을 결합할 수 있는 방법이 없었습니다."
TransitID는 세포 사이를 이동하는 단백질을 추적하는 데에도 적합합니다. 이 수준에서 단백질 세부 사항 및 활동을 추적하면 세포가 통신하는 방법에 대한 알려지지 않은 정보가 드러날 수 있습니다. 또한 암 및 신경 퇴행성 질환 분야를 포함하여 다양한 질병 및 치료 연구에 분명한 응용이 있습니다.
3. Cell: 새로운 백신은 새로운 코로나바이러스 에 대한 더 많은 항체를 생성합니다.
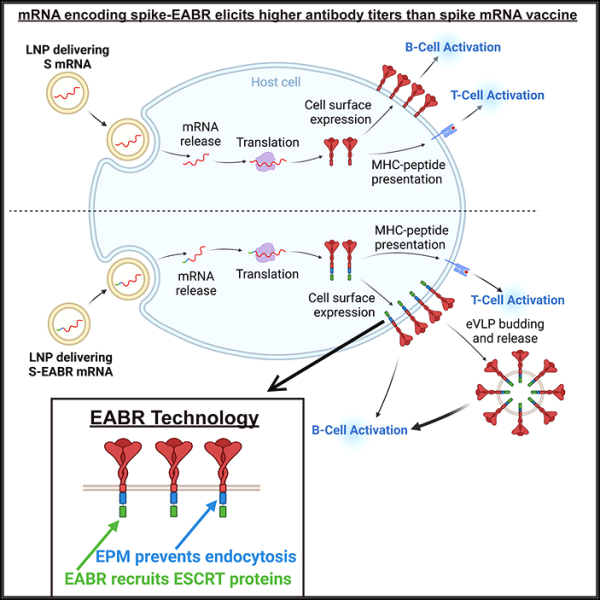
새로운 연구에서 Caltech에서 개발된 새로운 기술은 COVID-19를 유발하는 코로나바이러스인 SARS-CoV-2를 시작으로 보다 강력한 백신을 만드는 것을 목표로 합니다 . 마우스 연구에서 프로토타입 백신은 현재 COVID-19 백신보다 5배 더 많은 항체를 유도했습니다. 새로운 백신에 의해 생성된 항체는 SARS-CoV-2의 원래 변종인 델타 변종과 오미크론 변종에 대해 효과적입니다. 관련 연구 결과는 최근 셀(Cell) 저널에 게재되었으며, 논문 제목은 "SARS-CoV-2 스파이크에 대한 ESCRT 모집이 mRNA 백신을 개선하는 바이러스 유사 입자를 유도합니다"입니다. 새로운 연구는 Caltech의 생물학 및 생명 공학 교수인 Pamela Björkman의 연구실에서 수행되었습니다. 이 연구는 Magnus Hoffmann이 주도했습니다.
2023, doi:10.1016/j.cell.2023.04.024
새로운 백신 후보는 화이자와 모더나의 백신에 사용되는 mRNA 기술의 특징과 노바백스의 백신과 같은 단백질 나노입자 기반 백신의 특징을 결합했기 때문에 "하이브리드" 백신이라고 합니다. COVID-19와 싸우는 데 도움이 되는 것 외에도 이 기술은 언젠가 HIV, 인플루엔자 바이러스 및 기타 다양한 병원체에 대한 백신을 개선할 수 있습니다.
Björkman은 "모든 백신 접종이나 감염과 마찬가지로 항체 수준은 시간이 지남에 따라 감소합니다. 이상적인 백신은 강력한 면역 반응을 생성하고 높은 수준의 항체를 유도하며 바이러스의 여러 변종에 의한 감염을 약화시키고 세포 독성을 유발합니다."라고 말했습니다.
4. Cell: 후생유전학적 변화는 신경교종으로 이어질 수 있습니다.
암은 종종 세포 DNA의 돌연변이 및 기타 변화로 인해 발생하지만 Dana-Farber Cancer Institute와 Broad Institute의 연구원들은 난치성 뇌종양인 신경교종(gliomas)이 후성유전체(epigenome)의 변화로 인해 발생할 수 있음을 발견했습니다. DNA 자체의 서열을 바꾸지 않고 유전자 활동을 바꾸는 DNA에 축적된 화학적 변형(예: 메틸화). 관련 연구 결과는 2023년 7월 25일 학술지 Cell에 "Modeling epigenetic lesions that cause gliomas"라는 논문 제목으로 온라인 게재될 예정이다.
규제 요소를 방해하는 후생적 병변은 잠재적인 암 유발 요인입니다. 그러나 발암 효과를 검증하기 위한 실험 모델이 부족합니다. 새로운 연구에서 저자들은 DNA 과메틸화를 나타내는 isocitrate dehydrogenase-mutant gliomas에서 보이는 이상을 모델링했습니다.
저자들은 암을 유발하는 발암 유전자인 PDGFRA와 암을 예방하는 종양 억제 유전자인 Cdkn2a를 포함하여 인간 신경아교종에서 후생유전학적으로 활동이 변경되는 두 개의 유전자를 확인했습니다.
연구 모델에서 그들은 이 후성유전학적 변화가 암유전자 PDGFRA를 활성화하는 동시에 신경아교종 형성을 자극하기 위해 동시에 작용하는 종양 억제 유전자 Cdkn2a를 침묵시키는 것을 발견했습니다. 이러한 발견은 신경아교종을 억제하기 위해 후성유전체를 표적으로 하는 치료제의 가능성을 강조합니다.
5. Cell: 암을 극복한 환자에게서 여러 암 관련 표적을 동시에 인식할 수 있는 킬러 T 세포 발견
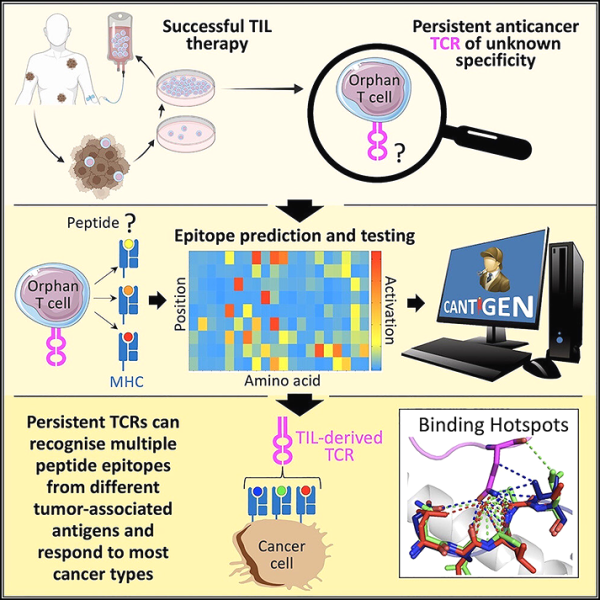
새로운 연구에서 카디프 대학과 영국의 다른 연구 기관의 연구원들은 진행성 고형암을 성공적으로 치료한 환자에게서 진행된 킬러 T 세포 클래스를 발견했습니다. 그들은 이러한 지배적이고 성공적인 킬러 T 세포가 동시에 여러 암 관련 표적을 인식한다는 것을 보여줍니다. 해당 연구 결과는 2023년 7월 24일 Cell 저널 온라인 게재 예정이다. 논문 제목은 "Targeting of multiple tumor-associated antigens by individual T cell receptors during successful cancer immunotherapy"이다.
저자는 덴마크 국립 암 면역 요법 센터(CCIT-DK)에서 종양 침윤 림프구(TIL) 요법을 받은 진행성 고형암 환자를 연구했습니다. TIL 요법은 환자의 종양에서 백혈구(T 세포)를 채취하여 실험실에서 대량으로 성장시킨 다음 환자에게 다시 주입하여 면역 체계가 암세포를 죽이는 것을 돕습니다. CCIT-DK는 유럽에서 TIL 치료의 선구자입니다.
지난 10년 동안 수행된 I/II상 임상 시험에서 31명의 환자가 TIL 요법을 받았습니다. 이 환자들에게 제공되는 모든 TIL 세포는 T 세포입니다. 그런 다음 그들은 어떤 T 세포가 반응하는지 보기 위해 저장된 환자 자신의 종양 세포 샘플로 이 환자의 혈액 세포에 도전했습니다. 그들은 암 생존자들이 암을 제거한 지 1년이 넘도록 암에 대해 여전히 매우 강력한 킬러 T 세포 반응을 보인다는 것을 발견했습니다.
2023, doi:10.1016/j.cell.2023.06.020
그런 다음는 이 킬러 T 세포가 어떻게 암세포를 정상 세포와 구별하는지 연구했습니다. 그들은 알고리즘을 사용하여 T 세포가 반응하는 것과 건강한 세포와 암세포 사이에 존재하는 것으로 알려진 단백질 차이를 기반으로 암 특정 T 세포가 무엇을 인식할지 예측할 수 있었습니다.
그들은 여러 표적을 인식할 수 있는 이 새로운 T 세포가 암세포 내 단백질의 여러 변화를 인식한다는 것을 발견했습니다. 함께 그들은 여러 암 생존자에게서 여러 표적을 인식하는 이 T 세포를 발견했습니다. 논문의 수석저자인 카디프대 의과대학 앤디 시웰 교수는 “TIL 치료를 받은 일부 진행성 암 환자가 어떻게 성공적으로 암을 완치했는지 알고 싶어서 찾았고 TIL 치료 후 암이 완치되었습니다. 우리는 완전히 제거된 환자의 혈액에서 성공적인 T 세포를 추적했습니다. "
"이 결과는 암 생존자의 다중 표적 킬러 T 세포가 일반적인 암과 싸우는 킬러 T 세포보다 암을 훨씬 더 잘 인식한다는 것을 보여줍니다. 또한 여러 암 관련 단백질에 동시에 반응할 수 있는 능력은 이러한 T 세포가 대부분의 유형에 반응할 수 있음을 의미합니다. 암이 위험한 것으로 인식되어 죽기 위해서는 이러한 비정상적인 표적 중 하나만 발현하면 되기 때문입니다. 우리는 TIL치료 환자의 혈액에서 여러 표적을 인식할 수 있는 많은 수의 T 세포가 발견되었습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.