2023년 6월 면역세포 주요 발표
페이지 정보
작성자 PnH 조회110회 작성일 24-05-30 15:00본문
6. Nat Commun: 유방암 내성의 분자 메커니즘을 극복할 것으로 기대됩니다.
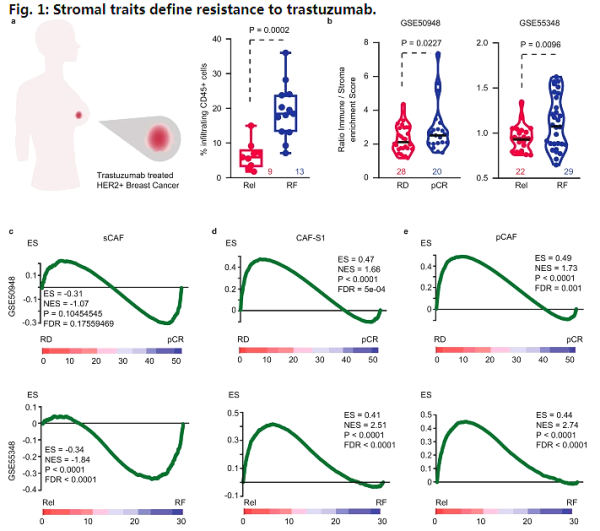
HER2+ 유방암에서 종양을 둘러싼 미세환경은 종양을 보호하고 널리 사용되는 치료법인 단일클론항체 트라스투주맙과 종양 미세환경에서 섬유아세포라고 불리는 특별한 유형의 세포에 대한 저항성을 발달하도록 도울 수 있습니다. 이 세포들은 기능을 차단하는 데 중요한 역할을 합니다. 면역체계를 보호하고 종양을 보호하며 이를 극복하는 방법을 찾으면 종양 세포를 죽이는 새로운 치료법의 능력을 향상시킬 수 있습니다. 구체적으로, TGF-β 활성화 섬유아세포의 존재는 높은 수준의 HER2 단백질을 발현하기 위해 약물 트라스투주맙에 의해 표적화된 면역 세포로부터 종양을 보호하는 FAP라는 분자를 발현합니다. HER2 단백질은 항종양 효능의 주요 원인입니다 암세포에 결합하고, 암에 결합하면 체내에서 강력한 면역 반응을 활성화합니다.
그러나 많은 종양에서 면역 체계가 종양을 둘러싼 미세 환경을 뚫고 암을 파괴하지 못하는 무능력은 치료에 대한 저항으로 이어지고 암이 약물을 회피하고 더 증식할 수 있는 능력을 증가시킵니다. 최근 국제학술지 네이처 커뮤니케이션즈(Nature Communications) 에 게재된 "Targeted immunotherapy against distinct cancer-associated fibroblasts 극복 치료 저항성 in refractory HER2+ breast tumors"라는 제목의 연구 보고서에서 스페인 암 생물 의학 연구 센터 및 기타 기관의 연구원들은 분자 프로세스를 트리거하는 메커니즘 확인 하였습니다.
Nature Communications (2022) DOI: 10.1038/s41467-022-32782-3
연구자들은 유방암 환자의 살아있는 세포를 포함하는 체외 모델을 사용하여 종양이 스스로를 보호하고 면역 체계가 종양 세포에 작용하도록 하는 방식을 극복할 수 있는 새로운 방법을 확인했습니다. 섬유아세포에 의해 발현되는 FAP 분자를 표적으로 삼으면, 면역 세포에 들어가는 이 조직의 능력이 역전될 수 있습니다. Alexandre Calon 박사는 FAP-IL2v 분자가 이 요법에 저항하는 미세 환경을 포함하는 시험관 내에서 재구성된 종양에 추가되었을 때 트라스투주맙의 효능이 면역 세포와 접촉 시 회복되었다고 말했습니다. 다른 유형의 종양에도 동일하게 적용할 수 있습니다.
7 Nat Commun: CRISPR 스크리닝은 전립선암에서 PARP 억제제의 민감도와 내성을 식별할 수 있습니다.
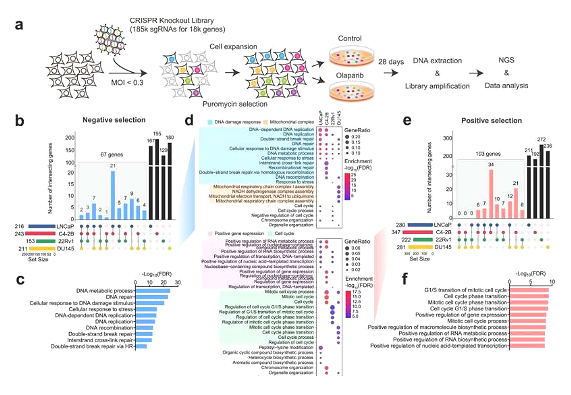
BRCA1/2 돌연변이를 가진 전립선 종양은 PARP 억제제에 비정상적으로 민감 하고 다른 DNA 손상 반응(DDR, DNA damage response) 유전자의 변화에 덜 반응하는 경향이 있는데, PARP 억제제의 반응은 중요한 영향을 미칩니다. 국제학술지 인 네이처 커뮤니케이션즈 (Nature Communications)에 게재된 "CRISPR은 전립선암에서 PARP 억제제 민감도와 저항성의 유전적 결정 요인을 밝힙니다" 다나-파버 브리검 암 연구 센터 및 기타 기관의 연구원들이 게놈 차원의 CRISPR-Cas9 녹아웃을 달성했습니다. BRCA1/2-null 종양 이외의 PARP 억제제 사용을 알리고 전립선암에 대한 현재 연구를 지원하기 위한 목적으로 다국적 공동 연구를 수행하여 PARP 억제의 바이오마커를 재평가했습니다.
Nature Communications (2023) DOI: 10.1038/s41467-023-35880-y
이 논문에서 연구원들은 전립선암에서 PARP 억제제에 대한 반응의 예측 바이오마커 역할을 할 수 있는 MMS22L 및 RNASEH2B와 같이 전립선암에서 자주 녹아웃되는 여러 새로운 유전자를 확인했습니다. 연구자들은 또한 올라파립에 대한 FDA 승인 바이오마커인 CHEK2의 소실이 PARP 억제에 대한 내성을 매개하지만 지속성은 매개하지 않는다는 사실을 발견했습니다.
PARP 억제제를 포함한 현재의 표적 암 치료법은 동시 게놈 변화를 무시하고 단일 유전자의 돌연변이에 의해 주로 유도된다고 연구원들은 말했습니다. 그들은 PARP 억제제에 대한 민감도가 대신 여러 게놈 변경의 상호 작용에 의존하므로 포괄적인 게놈 프로파일링이 환자의 임상 의사 결정을 개선하는 데 도움이 될 수 있음을 발견했습니다.
8 소화기학: 대장암 세포 및 암 치료 내성 극복에 도움
결장직장암(CRC)은 식이 영양에 의해 고도로 규제되는 파괴적인 질병이며, mTORC1은 종양 성장을 촉진하고 치료 반응을 제한하며, 성장 인자 신호는 mTORC1 활성화의 주요 메커니즘입니다. 최근 국제학술지 Gastroenterology 에 게재된 "Dysregulated amino acid sensing drives colorectal cancer growth and metabolism reprogramming leading to chemoresistance"라는 제목의 연구 보고서에서 University of Michigan 및 기타 기관의 과학자들은 연구를 통해 식이 변화가 건강 증진의 열쇠가 될 수 있음을 발견했습니다.
암세포가 생존하고 성장하기 위해서는 영양분이 필요합니다. 제한되면 세포는 영양 감지 캐스케이드를 낮추고 mTORC1을 끕니다. mTORC1이 결장암 에서 과활성화되는 것으로 알려져 있지만 중요한 질문은 결장 종양이 영양소 감지 경로를 인식하여 작동시키는지 여부였습니다.
연구원인 야트릭 샤(Yatrik M. Shah) 박사는 대장암의 경우 종양에서 이용할 수 있는 영양분이 줄어들면 세포가 성장할 영양분이 없으면 세포가 위기를 겪게 되며 이는 암으로 이어진다고 말했습니다. 세포와 생쥐에서 연구원들은 저단백 식단이 암 성장의 조절기인 mTORC1를 켜는 영양소 신호 경로를 차단한다는 사실을 발견했습니다. 현재 치료법에 ,저단백 식단, 특히 두 가지 주요 아미노산을 감소시키는 식단 패턴에 저항성을 유발하는 것으로 알려진 암에서 매우 활성화된 돌연변이는 GATOR라는 복합체를 통해 영양 신호를 변경할 수 있습니다.
GATOR1과 GATOR2는 서로 협력하여 mTORC1의 작동 모드를 유지할 수 있습니다. mTORC1 차단에 대한 이전 연구는 암 촉진 신호 억제에 초점을 맞추었지만 이러한 억제제는 심각한 부작용을 일으키고 환자가 약물 복용을 중단하면 암이 재발합니다. 따라서 영양소 경로를 차단하면 mTORC1을 종료하는 다른 방법을 제공할 수 있습니다.
9 Mol Cell Proteomics: 췌장암 치료제인 젬시타빈 내성의 주요 대사 조절제를 식별합니다.
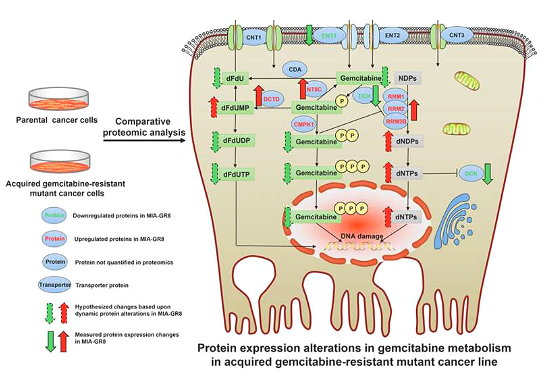
췌관 선암종(PDAC)은 치료 표준 치료인 젬시타빈(gemcitabine)이 약간의 생존 이점만 부여하고 약물에 대한 내성 발달이 종종 그 효능을 손상시키는 매우 불응성인 질병입니다. 최근 국제학술지 Molecular & Cellular Proteomics 에 게재된 "Comparative Proteomic Analysis Identifies Key Metabolic Regulators of Gemcitabine Resistance in Pancreatic Cancer"라는 제목의 연구 보고서에서 로스웰파크종합암연구센터 및 기타 기관의 과학자들은 연구를 통해 PDAC 치료에 사용되는 표준 화학 요법인 젬시타빈 약물에 대한 암 세포 내성이 확인되었습니다.
Molecular & Cellular Proteomics (2022) DOI: 10.1016/j.mcpro.2022.100409
젬시타빈 약물에 대한 암세포의 내성은 종종 임상 화학 요법 치료 중에 발생하여 환자의 예후가 좋지 않으며 젬시타빈에 대한 암세포의 내성 뒤에 숨겨진 분자 메커니즘을 이해하는 것은 과학자들에게 큰 도전이었습니다. 이 연구에서 연구원들은 종합 정량 프로테옴 분석을 사용하여 젬시타빈에 대한 PDAC 내성의 주요 대사 조절인자를 식별했습니다. 연구원들은 PDAC 암세포를 체계적으로 프로파일링하고 치료 개선에 도움이 되는 표적이 될 수 있는 약물 내성에 대한 여러 A 치료 취약성을 식별했습니다.
PDAC는 현재의 요법이나 다른 암 치료에서 잘 수행된 일부 새로운 면역 요법에 반응하지 않으며, 젬시타빈은 PDAC 환자 치료를 위한 주요 약물이며, 환자에게 약간의 생존 이점만 제공할 수 있습니다. 젬시타빈 약물 내성은 매우 빠르며 환자의 치료 효과에도 영향을 미칩니다. 이를 위해 이번 연구에서 연구진은 높은 젬시타빈 내성을 획득한 여러 암 세포주를 개발했습니다. 연구원들은 개발된 세포주에서 젬시타빈에 대한 더 큰 민감도 손실이 고도의 약물 내성 상태를 생성하기 위해 함께 작동하는 PDAC 세포의 유전자를 식별하는 데 도움이 될 수 있다는 가설을 테스트하기 위해 보다 상세한 단백질 분석을 사용했습니다.
10 Nat Commun: 특수 단백질을 사용하여 췌장암의 분자 메커니즘 밝히기
췌장암은 미국에서 폐암과 대장암에 이어 세 번째로 치명적인 암 유형이며 흔하지는 않지만 췌장암 줄기세포가 췌장암 환자 의 5년 생존율을 높이기 때문에 효과적으로 치료하기 가장 어려운 암 중 하나로 남아 있습니다. 화학 요법 및 새로운 암 면역 요법과 같은 향성 요법에 대한 내성의 급속한 발달로 인해 약 10%에 불과합니다. 최근 국제학술지 인 네이처 커뮤니케이션즈( Nature Communications) 에 게재된 "Smarcd3 is an epigenetic modulator of the metabolism landscape in pancreatic ductal adenocarcinoma"라는 제목의 연구 보고서에서 캘리포니아 대학 및 기타 기관의 과학자들은 췌장암 세포가 어떻게 통과하는지에 대한 치료법을 밝혔습니다.
이전 연구 결과는 췌장암에서 치료에 대한 내성이 기존 약제에 대한 차등 반응에서 발생하며 종양 세포 이질성(다양성), 특히 치료에 대한 내성을 촉진하는 줄기 세포 특성이 이러한 반응을 촉진한다고 제안했습니다. 이 연구에서 연구원들은 게놈의 변화(유전자 자체에 특이적인)가 아니라 후성유전체학(게놈에 무엇을 해야 하는지 알려주는 단백질 모음)의 변화가 어떻게 암세포 저항성을 유발하는지 조사했습니다.
췌장암 줄기세포는 기존 치료법에 저항하고 종양 재발을 유발하는 공격적인 암세포로, 이러한 줄기세포는 스스로를 보호하고 암의 생존과 성장을 촉진하기 위해 후생유전학적 조절 메커니즘에 의존한다고 연구원 Reya는 말했습니다. 그래서 우리는 암 줄기세포가 치료에 대한 암 내성의 이면에 있는 메커니즘을 더 잘 이해하기 위해 사용하는 근본적인 도구와 메커니즘, 그리고 암세포 저항성을 우회하는 방법을 확인하기 위해 연구를 하고자 합니다
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.