2023년 CAR-T치료 논문 발표 11월
페이지 정보
작성자 PnH 조회268회 작성일 24-05-31 03:16본문
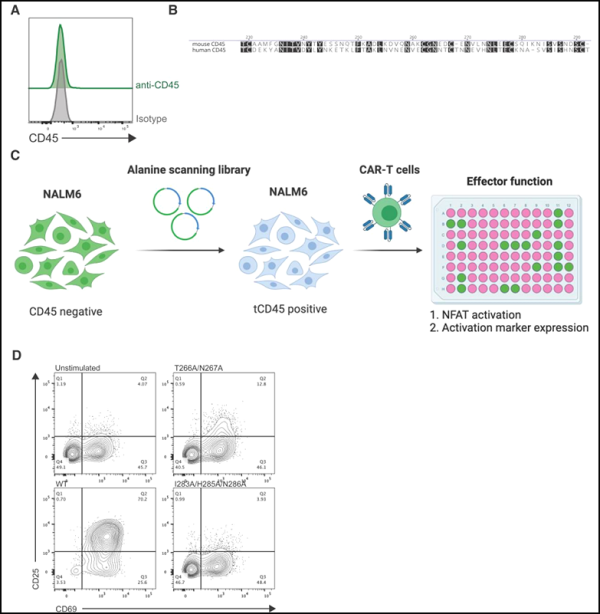
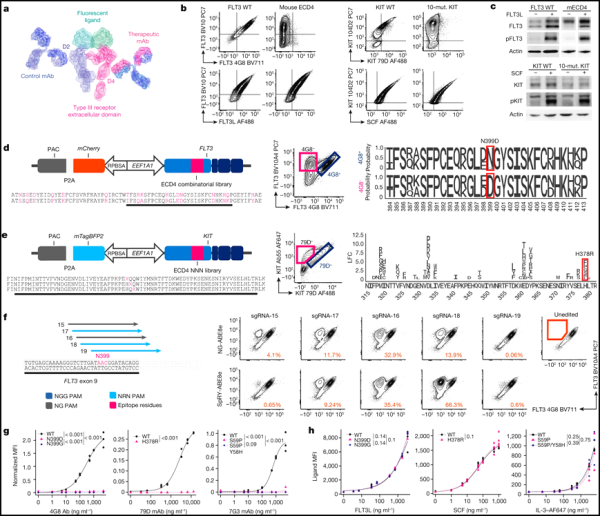
1. Science Translational Medicine: CD45를 표적으로 하는 Epitope 편집으로 모든 혈액암 치료를 위한 보편적인 CAR-T 세포치료제 개발에 연구가 진행중입니다.
현재 CAR-T 세포 치료법은 5가지 혈액암 아형을 치료하는 데 승인되었습니다. 새로운 연구에서 펜실베니아 대학교 페렐만 의과대학의 연구원들은 전임상 테스트에서 이 접근법의 잠재적인 효능을 확인했습니다. 그들은 거의 모든 혈액암 세포를 포함하여 거의 모든 혈액 세포의 표면에서 발견되는 마커인 CD45를 표적으로 삼기 위해 유전자 조작 CAR-T 세포를 사용했습니다. CD45가 건강한 혈액 세포에도 존재한다는 점을 고려하여 그들은 CD45 표적화 전략의 과제를 극복하기 위해 CRISPR 염기 편집 기술을 사용하여 Epitope 편집이라는 방법을 개발했습니다.
관련 연구 결과는 'Science Translational Medicine' 저널에 2023년 8월 31일자 온라인 게재됐다. 논문 제목은 'Epitope base editing CD45 in hematopoietic cells enables universal blood cancer immune therapy Science Translational Medicine'입니다.
Science Translational Medicine, 2023, doi:10.1126/scitranslmed.adi1145
CD45가 거의 모든 혈액 세포에 존재하고 종종 혈액암 세포에서 고도로 발현된다는 점을 감안할 때 모든 CD45 운반 세포를 제거하는 치료법은 환자에게 적혈구, 혈소판, 혈장 또는 심지어 골수를 포함한 혈액 세포가 없는 상태를 남길 수 있습니다.
이 문제를 극복하기 위해 저자는 CRISPR 기본 편집 기술을 사용하여 이전 작업을 기반으로 Epitope 편집이라는 새로운 기술을 개발했습니다. 여기에는 CAR-T 세포와 조혈 줄기 세포를 유전적으로 변형하여 CAR-T 세포가 결합하는 CD45 구조, 즉 "Epitope"의 작은 부분을 변경하는 것이 포함됩니다.
논문의 제1저자인 닐스 웰하우젠(Nils Wellhausen)은 “이것은 본질적으로 조혈모세포 이식과 CAR-T 세포 치료법을 결합한 것”이라며 “이 아이디어는 CAR-T 세포가 체내에 이식되면 정상적인 CD45를 갖고 있는 암세포를 죽이는 것”이라고 말했습니다. 하지만 서로 죽이거나 유전자 변형 혈액 줄기세포를 죽이지는 않습니다. 이를 통해 유전자 변형 혈액 줄기세포가 새로운 혈액 세포를 만들기 시작할 수 있습니다."
저자는 세포 배양 및 실험모델의 광범위한 실험에서 이 전략을 테스트했습니다. 연구진은 이 새로운 방법이 CD45를 표적으로 하는 CAR-T 세포가 서로 죽고 조혈줄기세포를 공격하는 것을 방지할 뿐만 아니라 혈액세포암을 신속하게 제거한다는 사실을 발견했습니다. 한 테스트에서 CD45를 표적으로 하는 CAR-T 세포는 주입 후 3주 이내에 백혈병 세포를 제거했으며 2개월 이상 후에도 여전히 존재하여 백혈병 세포를 제거했습니다.
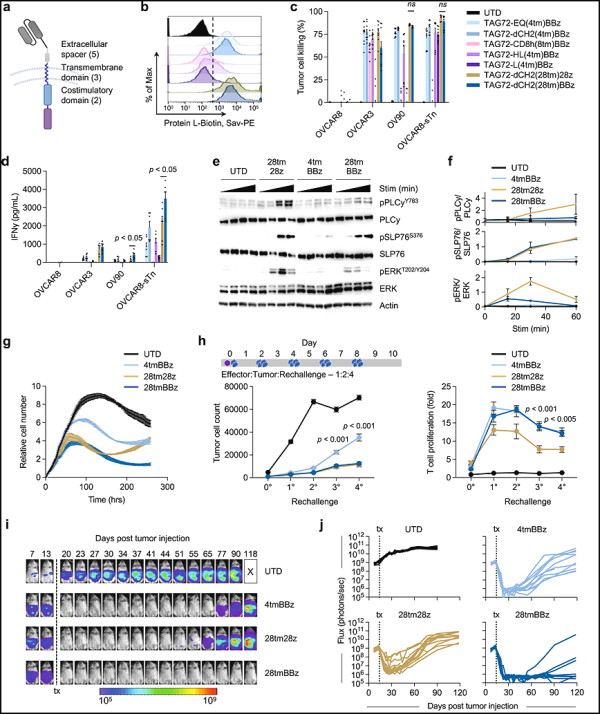
2. Nature Communications : 개선된 CAR-T 세포가 난소암과 같은 고형 종양을 치료할 가능성이 있음을 보여줍니다.
난소암은 공격적인 고형 종양입니다. 재발성 난소암 및 기타 고형 종양 환자에 대한 효과적인 치료 옵션은 거의 없습니다. 이를 바꾸기 위해 미국 City of Hope의 연구자들은 새로운 전임상 연구에서 종양 관련 당단백질-72(TAG72)를 특이적으로 인식하는 키메라 항원을 발현하도록 유전자 변형되었음을 확인했습니다. T 세포(TAG72-CAR-T 세포)는 배양 내 세포 모델 및 전임상 모델에서 진행성 난소암에 효과적입니다.
관련 연구 결과는 2023년 8월 7일 Nature Communications 저널에 게재되었습니다. 이 논문의 제목은 "Antigen-dependent IL-12 signaling in CAR T cells promotes regional to systemic disease targeting" 논문의 교신저자는 City of Hope의 T 세포 치료 연구실 Saul Priceman 박사입니다.
Nature Communications, 2023, doi:10.1038/s41467-023-40115-1
흥미롭게도 TAG72는 난소암 표면뿐만 아니라 췌장암 , 대장암, 유방암 및 뇌암을 포함한 다른 고형 종양에도 존재합니다. 이는 TAG72-CAR-T 세포치료제가 난소암, 췌장암, 대장암, 유방암, 뇌암 등 고형암 치료에 가능성이 있다는 것을 의미합니다.
이 새로운 연구는 CAR 분자의 다양한 영역을 변경하고 배양내 및 생체 내 전임상을 통해 기능적 차이를 체계적으로 테스트함으로써 CAR 기능을 포괄적으로 최적화하는 이점을 강조합니다. 저자는 TAG72-CAR-T 세포의 표면에 항원 의존성 mbIL12를 도입함으로써 증가된 IFNγ 신호 전달과 TAG72-CAR-T 세포에 의한 고형 종양의 향상된 사멸을 연결했습니다. 이 도입은 국소적인 종양 제어를 개선했을 뿐만 아니라 TAG72-CAR-T 세포의 전신 확장 및 지속성을 향상시켜 전신 종양 근절을 촉진했습니다. 이러한 발견은 다발성 전이성 질환에 대한 TAG72-CAR-T 세포의 치료 반응을 광범위하게 향상시킬 것으로 기대됩니다.
3. Nature Immunology : CTLA-4 세포 융합은 CAR-T 세포의 항종양 효과를 향상시킵니다.
CAR-T 세포 요법이라고 불리는 유망한 유형의 면역 요법에서는 환자의 T 세포가 암세포 표면의 항원을 더 잘 인식하고 공격하도록 유전적으로 변형됩니다. 이 치료법은 현재 림프종과 백혈병 치료용으로 승인되었지만 단점도 있습니다. 암을 죽이는 사이토카인 속에서 유전자 변형 T 세포 중 다수가 잔류 암 항원으로 오염되어 다른 T 세포를 공격하게 되었습니다.
그러나 새로운 연구에서 미국 예일대학교 연구진은 이러한 킬러 T 세포의 자기 파괴적 경향을 길들이는 방법을 발견했습니다. 그들은 치료를 위해 이러한 조작된 T 세포에 분자를 융합하는 것만으로도 서로를 공격하는 경향을 억제할 수 있다고 말합니다. 관련 연구 결과는 'CTLA-4 tail fusion enhances CAR-T antitumor immunity'라는 제목으로 네이처 면역학(Nature Immunology) 저널에 2023년 7월 27일 온라인 게재됐습니다.
논문의 공동 제1저자인 Xiaoyu Zhou와 Hanbing Cao가 주도한 이 새로운 연구에서 저자들은 CTLA-4 세포질 (CCT)를 조작된 CAR-T 세포에 융합시켰습니다. CCT는 T 세포를 조절하여 면역 체계를 조절하는 것으로 알려진 자연 발생 인간 단백질 CTLA-4의 일부입니다. 그들은 CCT와 융합된 CAR-T 세포가 CCT가 없는 CAR-T 세포보다 실패할 가능성이 적고 더 오래 생존한다는 것을 관찰했습니다.
Zhou는 "CCT 꼬리를 운반하도록 유전자 변형된 CAR-T 세포는 반응성이 낮지만 암세포를 죽이는데 더 지속성이 있습니다"라고 말했습니다.
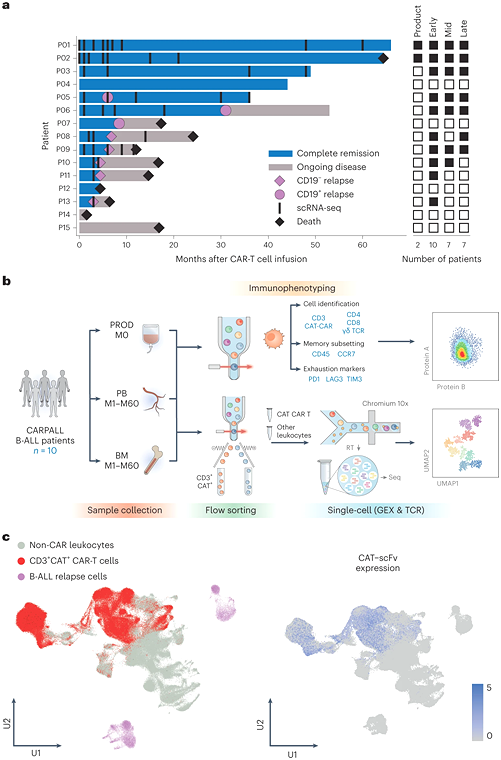
4. Nature Medicine: 소아 백혈병환자에게 지속되는 효과적인 CAR-T 세포의 유전적 특징을 확인했습니다.
University College London, Great Ormond Street Hospital 및 Wellcome Sanger Institute의 연구원들은 새로운 연구에서 일부 어린이들이 백혈병의 최첨단 치료법인 CAR T 세포를 받는 이유에 대한 새로운 통찰력을 발견했습니다. 다른 아이들보다. 그들은 장기적으로 가장 효과적인 CAR T 세포의 유전적 특징을 식별하기 위해 새로운 면역요법 설계에 대한 전문 지식과 AI 분석을 결합했습니다. 관련 연구 결과는 2023년 7월 네이처 메디신(Nature Medicine) 저널에 "Transcriptional signatures associated with persisting CD19 CAR-T cells in children with leukemia"라는 제목으로 게재되었습니다.
Nature Medicine, 2023, doi:10.1038/s41591-023-02415-3.
새로운 연구는 일부 CAR-T 세포가 왜 그렇게 오랫동안 지속되는지 이해하는 첫 번째 단계를 제공합니다. 그들의 목표는 발견한 유전적 특징을 기반으로 세포 집단의 주요 마커를 식별하고 궁극적으로 치료가 시작되기 전에 장기간 생존하는 CAR T 세포를 발견하거나 생성할 수 있는 방법이 있는지 이해하는 것입니다.
논문의 제1저자이자 Wellcome Sanger Institute의 연구원인 Nathaniel Anderson 박사는 이렇게 말했습니다. "최첨단 단일 세포 유전체학을 통해 우리는 어린이의 CAR-T 세포 지속성에 대한 코드를 매우 명확하게 해독했습니다. 우리가 알고 있는 이 세포는 치료 후 어린이의 암을 예방하는 데 매우 중요합니다. 궁극적으로 이 연구는 우리가 이를 지속적으로 개선하는 데 도움이 될 것입니다. 우리는 이 연구를 통해 궁극적으로 CAR-T 세포 치료법을 제공하는 임상 팀이 어떤 환자가 치료에 가장 잘 반응하는지 더 잘 이해할 수 있게 되고 CAR-T조합에 대한 접근 방식을 최적화하여 환자에게 더 나은 결과를 가져올 수 있기를 바랍니다. .”
해당 논문의 공동 교신저자이자 그레이트 오몬드 스트리트 병원(Great Ormond Street Hospital) 소아 혈액학 컨설턴트인 사라 고라시안(Sara Ghorashian) 박사는 "이 데이터는 우리에게 처음으로 오래 지속되는 CAR-T 세포의 특성을 보여줍니다. 우리 연구에서는 ALL을 앓고 있는 소아 환자뿐만 아니라 다양한 유형의 백혈병에 대해 다양한 CAR-T 세포 제품으로 치료받은 성인 환자에서도 검증되었습니다. 따라서 이러한 특성 분석이 CAR의 지속성 메커니즘을 밝힐 수 있습니다 -T 세포를 보다 일반적으로 활용하여 더 나은 치료법을 개발할 수 있습니다.”
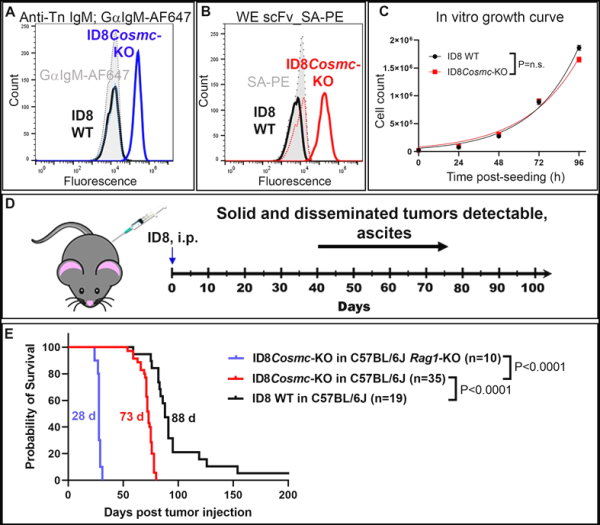
5. Journal for ImmunoTherapy of Cancer : CAR-T 세포치료가 난소암을 효과적으로 치료할 수 있을 것으로 기대됩니다.
일리노이대학교 어바나-샴페인 캠퍼스 연구진은 새로운 연구에서 올바른 표적을 찾을 수 있다면 CAR-T 세포 면역요법이 고형 종양을 효과적으로 치료할 수 있다는 사실을 발견했습니다. 그들은 지금까지 효과적인 CAR-T 세포 치료법이 발견되지 않았던 공격적인 고형 종양인 난소암 모델에 CAR-T 세포 치료법을 성공적으로 적용했습니다. 관련 연구 결과는 최근 Journal for ImmunoTherapy of Cancer에 "Single CAR-T cell treatment controls disseminated ovarian cancer in a syngeneic mouse model"라는 제목으로 게재되었습니다.
2023, doi:10.1136/jitc-2022-006509
논문 제1저자인 다이아나 로즈 라노아(Diana Rose Ranoa) 박사는 “진행된 종양 모델에서도 CAR-T 세포를 단회 투여해도 강력한 항종양 효과를 보였다”며 “아직 답해야 할 질문이 많지만, 이는 새로운 연구에 따르면 CAR-T 세포가 올바른 표적을 인식하면 이러한 유형의 암을 죽일 수 있습니다."
크란츠 교수는 “고형암에서 CAR의 표적은 혈액암의 표적과 다르며 건강한 조직에서 발견되지 않는 표적을 찾는 것이 어렵다”며 “또 다른 요인은 고형암 세포가 면역을 억제하는 고유한 방식을 가지고 있다는 점”이라고 말했습니다. 즉 좋은 표적을 찾고 이러한 표적을 인식하는 올바른 유형의 CAR을 찾기 위해 현재 많은 연구가 진행되고 있습니다."
새로운 연구에서 저자들은 건강한 세포보다는 고형 종양 세포의 표면에서 발견되는 탄수화물에 초점을 맞췄습니다. 그들은 이 탄수화물에 대해 서로 다른 친화성을 갖는 CAR 분자를 개발하여 먼저 난소암 세포의 배양에서 테스트한
다음 난소암에 걸린 살아있는 쥐에서 테스트했습니다. 그들은 이 탄수화물에 대해 가장 높은 친화력을 가진 CAR이 T 세포가 암을 발견하고 파괴하도록 돕는 데 매우 효과적이어서 첫 번째 투여 후 몇 달 만에 종양을 축소하거나 제거한다는 것을 발견했습니다.
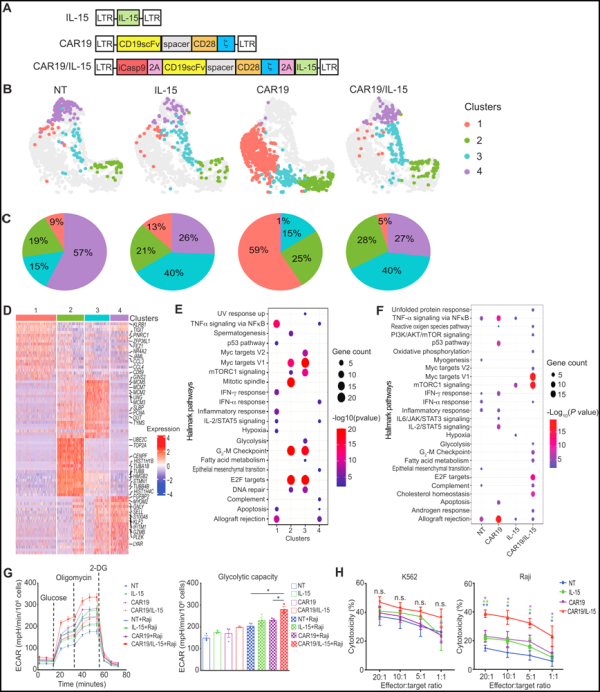
6. Science Advances: CAR-NK 세포의 대사 적응성 상실이 종양 저항성의 핵심 메커니즘임을 밝힘
텍사스대학교 MD 앤더슨 암센터 등 연구기관 연구진은 새로운 연구에서 키메라항원수용체(CAR) 발현 자연살해세포(CAR-NK)의 대사 능력 상실이 치료 저항성의 징후라는 사실을 발견했습니다. 신체에 주입된 CAR-NK 세포는 점차적으로 종양 세포와 영양분을 놓고 경쟁하는 능력을 잃어 종양이 재발하게 됩니다. 관련 연구 결과는 2023년 7월 28일 Science Advances 저널에 게재되었습니다.
논문 제목은 "Loss of metabolic fitness drives tumor resistance after CAR-NK cell therapy and can be overcome by cytokine engineering."
Science Advances, 2023, doi:10.1126/sciadv.add6997 .
이 연구는 인터루킨-15(IL-15)를 발현하도록 CAR-NK 세포를 유전적으로 변형하면 이들 세포의 대사 능력을 강화하고 보다 지속적인 항종양 반응을 제공할 수 있음을 보여줍니다. 또한, IL-15 발현 CAR-NK 세포를 2회 주입하면 1회 주입에 비해 생존율이 향상되었습니다.
전임상 연구의 일환으로 저자는 CD19 종양 항원(CAR19)을 표적으로 하는 CAR로 NK 세포를 유전자 변형했습니다. 그들은 림프종의 실험실 모델을 사용하여 CAR19 단독, IL-15 단독 또는 CAR19와 IL-15 모두를 발현하는 자연 살해 세포(NK 세포)를 평가하여 IL-15가 NK 세포를 활성화하고 효능과 지속성을 향상시키는 방법을 연구했습니다.
이 저자들은 NK 세포 집단이 생체 내 진화 및 종양 제어의 다양한 단계와 관련된 활성화, 기능 및 대사 특성의 뚜렷한 패턴을 가지고 있음을 관찰했습니다. 대사적으로 매우 활동적인 종양과의 상호작용으로 인해 NK 세포는 대사 능력을 잃게 되며, IL-15의 발현은 이러한 대사 손실을 부분적으로 극복할 수 있습니다.
7. Nature: 에피토프 편집을 통해 급성 골수성 백혈병에 대한 표적 면역요법이 가능합니다.
조혈줄기/전구세포(HSPC) 또는 HSPC에서 분화된 골수 세포에 의해 발현되는 AML 표적 유전자에 대한 현재의 면역요법은 허용할 수 없는 표적 외 독성을 초래할 수 있습니다. 새로운 연구에서 Dana-Farber 암 연구소의 연구자들은 기증자 HSPC를 유전자 변형하여 급성 골수성 백혈병(AML)에 대한 면역 요법에서 생존할 수 있도록 했습니다. 관련 연구 결과는 'Epitope editing enables targeted immunotherapy of acute myeloid leukaemia'라는 제목으로 네이처 저널에 2023년 8월 30일 온라인 게재됐습니다.
Nature, 2023, doi:10.1038/s41586-023-06496-5.
면역체계는 외부 항원(병원체 또는 종양의 일부)을 발견하면 이를 인식하고 중화시키려고 시도합니다. 면역 체계는 이러한 외부 항원의 "Epitope"를 인식하고 면역 반응을 일으킵니다. 키메라 항원 수용체(CAR) T 세포(CAR-T)와 단클론 항체는 악성 세포의 항원을 표적으로 삼아 혈액 악성 종양을 치료하는 데 큰 가능성을 보였지만 종양 특이성이 부족하여 제한이 있습니다. 이로 인해 치료 중에 건강한 세포와 조직이 손상될 위험이 있습니다.
이들 저자는 골수 이식을 위한 기증자 HSPC의 Epitope 조작을 입증하여 HSPC 또는 HSPC로부터 분화된 골수성 세포를 CAR-T 세포 또는 단클론 항체에 선택적으로 저항하게 하여 단백질 기능 또는 조절에 영향을 미치지 않도록 했습니다. 이러한 전략은 백혈병 세포 생존에 필요한 유전자가 조혈줄기세포에도 발현되는지 여부와 관계없이 표적화할 수 있어 유해한 비표적 부작용을 줄이고 백혈병 면역 회피 위험을 줄여 치료의 안전성과 유효성을 향상시킬 수 있습니다.
CAR-T 세포로 치료한 후, 그들은 이 에피토프 편집된 HSPC의 저항성을 확인하고 동시에 환자 유래 급성 골수성 백혈병 이종이식편을 근절했습니다. HSPC의 Epitope 편집으로 인해 특정 항체 결합 부위가 손실되어 생리학적 성능, 조절 및 세포내 신호 전달에 영향을 주지 않으면서 CAR-T 세포 및 단일클론 항체에 대한 내성을 갖게 됩니다.
또한, 그들은 HSPC에 대해 다중 Epitope 편집이 가능하여 부수적인 표적 이탈 독성 없이 다중 단백질 표적에 대해 보다 효과적인 면역요법을 가능하게 한다는 것을 보여줍니다. 그들은 Epitope 변형이 급성 골수성 백혈병뿐만 아니라 다른 혈액학적 악성 종양에도 적용될 수 있고, 비악성 질환의 비유전독성 조절에도 적용될 수 있다고 믿습니다
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.