2023년 Nature 10월 발표 내용 요약
페이지 정보
작성자 PnH 조회132회 작성일 24-05-31 04:05본문
1.Nature: 유전자 조작으로 돼지의 신장을 원숭이에 이식후 면역거부반응을 줄였습니다.
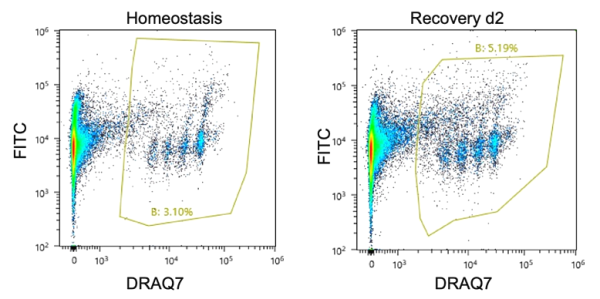
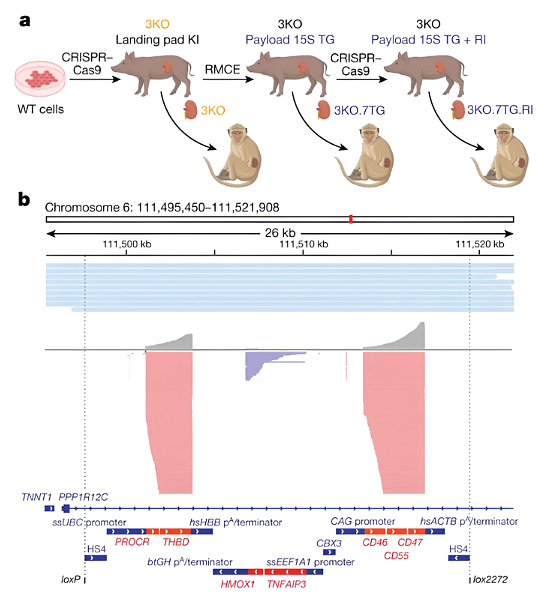
최근 국제잡지 네이처 (Nature )에 게재된 'Design and testing of a humanized porcine donor for xenotransplantation'라는 연구보고서에서 미국의 여러 연구기관 연구진이 여러 마리의 돼지의 게놈을 바꿔 신장이식에 성공한 것으로 발표했습니다. 사이노몰거스 원숭이를 대상으로 거부 가능성을 줄일 수 있는지 확인합니다. 그들은 게놈을 변경하면 영장류에 이식할 때 장기가 거부될 가능성이 줄어든다는 것을 발견했습니다.
Nature , 2023, doi:10.1038/s41586-023-06594-4
장기 부전 환자 치료의 주요 방법 중 하나는 기증자로부터 장기를 이식하는 것입니다. 안타깝게도 그러한 장기는 기증이 부족합니다. 따라서 연구원들은 줄기세포 에서 새로운 장기를 성장시키거나 , 비생물학적 물질로 새로운 장기를 만들거나, 동물의 장기를 이용하는 등의 대안을 모색해 왔습니다 . 후자의 접근법은 초기에는 성공을 거두었지만 수혜자의 면역체계가 기증자의 장기를 공격하는 장기 거부반응은 여전히 문제로 남아 있습니다. 새로운 연구에서 저자들은 동물 기증자의 게놈을 변경하여 장기가 면역거부반응을 겪을 가능성을 낮추는 새로운 접근법을 테스트했습니다.
구체적으로 저자들은 돼지에서 69개의 유전자를 편집했습니다. 유전자 중 3개는 거부반응과 관련된 분자 생성에 관여하고, 59개 유전자는 여러 세대 전에 돼지 게놈에 내장된 레트로바이러스 DNA와 관련이 있습니다. 마지막 7개에는 부적절한 혈액 응고를 방지하는 등 건강한 장기 성장을 촉진하는 것으로 알려진 인간 유전자를 추가하는 것이 포함되었습니다.
2. Nature: 해양의 독소 분자가 새로운 항암 치료법 개발에 도움이 될 수 있습니다.
해양에서 발견되는 고리형 독소인 포르티민 A와 포르티민 B는 화학적 구조와 상당한 항암 잠재력으로 인해 연구원들로부터 많은 주목을 받았지만, 지금까지 연구자들은 이러한 독소를 대량으로 확보하지 못했습니다. 이러한 독소에 의해 생성되는 강력한 활동 뒤에 숨은 메커니즘은 아직 연구자들에게 명확하지 않습니다. 최근 국제잡지 네이처 (Nature )에 게재된 "Synthesis of portimines reveals the basis of their anti-cancer activity"라는 제목의 연구 보고서에서 스크립스 연구소 등의 과학자들은 연구를 통해 해양 플랑크톤을 활용하는 방법을 발견했습니다. 연구자들은 해양 독소인 포르티민 A와 포르티민 B를 합성하는 단계를 자세히 설명했으며, 이를 통해 연구원들은 이들의 특성에 대한 보다 심층적인 연구를 수행할 수 있습니다.
이러한 독소는 유일한 생산자가 Vulcanodinium Rugosum이라고 불리는 일종의 해양 플랑크톤이기 때문에 현재 대량으로 얻기가 어렵습니다. 이러한 독소의 활성을 테스트하기 위해 연구자들은 먼저 이러한 독소를 대량으로 합성하는 새로운 방법을 개발해야 합니다. 합성은 대부분의 산소 원자가 없는 최소한으로 탄소 골격을 구성하는 것으로 시작됩니다. 목표는 올바른 산소화 패턴과 입체화학을 설치하는 것입니다. 이 이상적인 분자를 손에 넣은 후 연구자의 다음 단계는 이것이 암세포와 어떻게 상호작용하는지 관찰하는 것입니다.
그런 다음 연구자들은 Jurkat 백혈병 , 전이성 섬유육종 세포, 삼중 음성 유방암 , 교모세포종 뇌종양 침윤 세포주를 포함한 20개의 인간 및 쥐 암 세포주와의 상호 작용을 테스트한 후 모든 암에 걸쳐 포르티민 A의 사용을 평가했습니다. 연구진은 세포주에서 지속적으로 강력한 세포독성을 관찰한 반면, 완전 합성 포르티민 B의 치료 효능은 크게 감소했습니다. 대장암 시험 모델 로 사용되는 MC38 세포를 포함한 다양한 암 세포주에서 포르티민 A는 효과적인 세포사멸 유도제로 확인되었으며, 포르티민 A에 의한 세포사멸은 비암세포에도 중요합니다. 크기가 작고 독성도 낮았습니다.
3 Nature : 소분자 면역요법 후보는 종양 세포 와 면역 세포를 모두 표적으로 삼아 보다 효과적인 암 치료를 예상합니다
PD-1 억제제 라고 불리는 암 면역요법 약물은 암과 싸우기 위해 면역체계를 자극하는 데 널리 사용되지만, 많은 환자가 이러한 약물에 반응하지 않거나 내성이 발생합니다. 초기 단계 임상 시험에서 테스트 중인 ABBV-CLS-484라는 새로운 소분자 약물 후보는 이러한 유형의 면역 요법에 대한 환자 반응을 향상시키는 것을 목표로 합니다.
최근 국제잡지 네이처 (Nature )에 게재된 "The PTPN2/PTPN1 inhibitor ABBV-CLS-484 unleashes potent anti-tumour immunity"라는 제목의 연구 보고서에서 미국 브로드연구소(Broad Institute) 등 연구진은 다음과 같이 보고했다. 약물 ABBV-CLS-484는 종양 성장을 늦추고 두 가지 다른 메커니즘을 통해 생존율을 향상시킵니다. 즉, 종양을 면역 공격에 더 민감하게 만들고 면역 세포의 활동을 강화합니다.
이 분자는 일반적으로 면역 세포를 활성화하는 신호를 감지하는 세포의 능력을 차단하는 PTPN2 및 PTPN1 단백질을 차단함으로써 작동합니다. 저자들은 이 분자가 PTPN2/N1을 억제함으로써 T 세포와 NK 세포라고 불리는 면역 세포를 종양 세포를 더욱 효과적으로 죽이는 세포로 바꾸는 동시에 종양 세포를 공격에 더욱 취약하게 만든다는 사실을 발견했습니다. PTPN2/N1을 차단하면 일부 암 면역요법에 대한 저항의 근원으로 여겨지는 T 세포 기능 장애의 일종인 T 세포 고갈을 줄이는 데도 도움이 됩니다. 종양 세포와 면역 세포 모두를 표적으로 하는 이 분자의 이중 작용 메커니즘은 PD-1 약물을 포함한 다른 암 면역요법과 비교할 때 독특하며 분자가 매우 효과적이어서 항PD-1 치료법과 같은 다른 약물과 병용할 필요조차 없을 수도 있습니다.
4.Nature: 자가 회복 메커니즘을 밝히면 보다 안전한 재생 치료법이 가능해질 수 있습니다
연구원들이 손상되거나 질병에 걸리거나 노화된 조직을 재생시킬 수 있는 치료법을 개발하려고 하기 때문에 손상된 장기가 어떻게 스스로 치유되는지 이해하는 것이 중요합니다. 여기에는 자가 치유가 완료된 후 중지하는 방법을 이해하는 것도 포함됩니다. 장기는 복구를 위해 새로운 세포를 생성해야 하지만 통제되지 않은 증식은 암으로 이어질 수 있습니다.
최근 국제잡지 네이처 (Nature )에 게재된 "Cholinergic neurons trigger epithelial Ca2+ currents to heal the gut"라는 제목의 연구 보고서에서 하버드 의과대학 및 미국의 다른 기관의 연구자들은 신경이 손상된 장의 과정을 완료하는 데 어떻게 도움이 되는지 연구를 통해 밝혔습니다. 정상적인 기능을 치유하고 회복하는 역할을 하며 재생이 어떻게 끝나는지에 대한 새로운 연구를 제공합니다.
Nature , 2023, doi:10.1038/s41586-023-06627-y
연구자들은 재생 생물학에서 이 풀리지 않는 문제에 대한 진전을 이루는 것이 흥미롭다고 말합니다. 연구원들은 인간의 장과 유사하지만 연구하기 쉬운 초파리의 장에서 이 사실을 발견했는데, 만약 이 발견이 인간에게 적용된다면 이를 치료하거나 예방할 수 있는 더 나은 방법을 찾을 수 있을 것입니다.
그녀는 파리와 인간의 장 손상을 일으키는 것으로 알려진 화학 물질을 초파리에게 먹이고 장이 스스로 회복되는 방법을 연구했습니다. 그녀는 인간과 초파리의 세포가 손상될 때 방출되는 것으로 알려진 종양 괴사 인자와 같은 염증 분자를 장 신경 그룹이 감지한다는 사실을 발견했습니다. 이러한 장 신경은 장 수축을 유발하는 등 다양한 효과를 갖는 신경 전달 물질인 아세틸콜린을 파리의 장 세포로 방출함으로써 반응합니다. 동시에 저자들은 아세틸콜린을 분해하는 효소의 수준을 줄이고 아세틸콜린에 반응하는 단백질의 수준을 증가시킴으로써 장 세포가 아세틸콜린에 대한 민감도를 증가시킨다는 사실을 발견했습니다. 이러한 변화로 인해 장 세포 사이의 작은 채널이 열리고 양전하를 띤 칼슘 이온이 포함된 전류가 이러한 세포를 통해 흐르게 되어 손상된 장의 치유가 촉진됩니다.
5.Nature: 심장 세포의 발현과 시작에 대한 사실이 밝혀졌습니다.
몇 개의 세포에서 완전히 기능하는 조직과 기관을 갖춘 완전한 유기체로의 발달은 세포가 정확한 방식으로 스스로 조직하고 함께 작동하기 시작해야 하는 복잡하지만 고도로 동기화된 과정입니다. 이 과정은 휴식 중인 세포가 완벽한 조화로 박동을 시작해야 하는 심장에서 특히 극적입니다.
최근 국제학술지 네이처 (Nature )에 'A bioelectrical phase transition patterns the first vertebrate heartbeats'이라는 제목의 연구보고서를 통해 미국 하버드 의과대학과 하버드대학교 연구진이 심장세포가 어떻게 뛰기 시작하는지를 엿볼 수 있었다. 제브라피시 연구에서 칼슘 수치와 전기 신호가 증가하면 심장 세포가 갑자기 동시에 박동하기 시작한다는 사실을 발견했습니다. 또한 그들은 각 심장 세포가 박동조율 세포 없이도 스스로 박동할 수 있는 능력을 가지고 있으며 심장 박동이 다른 위치에서 시작될 수 있다는 사실도 발견했습니다.
연구원인 션 메가슨(Sean Megason)은 “사람들은 심장 박동을 너무 중요하게 여겨 오랫동안 연구의 초점이 되어왔지만 이렇게 고해상도로 깊이 연구할 수 있었던 것은 이번이 처음”이라고 말했습니다. 호기심 많은 생물학자들에게 심장 박동의 기본 메커니즘을 이해하는 것은 그 자체로 흥미로울 수 있지만, 심장 박동을 조절하는 심장 시스템이 제대로 발달하지 않거나 오작동하기 시작할 때 무슨 일이 일어나는지 이해하는 것도 중요합니다.
아담 코헨 연구원은 사람의 일생 동안 심장은 약 30억 번 뛰며 결코 쉬지 않는다고 말했습니다. 우리는 이 놀라운 기계가 처음으로 어떻게 작동하는지 보고 싶었습니다. "저자들은 심장이 어떻게 뛰기 시작하는지 연구하려고 한 것이 아닙니다. 대신에 그들은 Cohen 연구소의 전기 활동 이미징 전문 지식과 Megason 연구소의 전문 지식인 제브라피시 세포 개발이 협력을 통해 이해 관계자들과 의사 소통하는 방법을 배우는 방법을 결합하는 과학적 질문을 추구하고 있었습니다. .
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.