2023년 Science: 10월 대표 발표 논문 요약
페이지 정보
작성자 PnH 조회96회 작성일 24-05-31 03:58본문
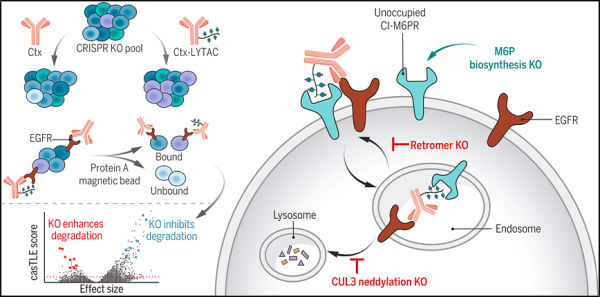
1. Science: 유해한 단백질을 분해하는 표적화 키메라의 작용 메커니즘에 대한 새로운 세부 사항을 밝히면 새로운 질병 치료법 개발로 이어질 수 있습니다.질병을 유발하거나 확산시키는 데 관여하는 유해한 단백질을 표적으로 삼을 때 약물은 종종 단백질의 활성 부위를 막아 기능을 방해하고 혼란을 야기합니다. 이러한 단백질을 표적으로 삼는 새로운 전략은 이를 세포 내 단백질처럼 작용하는 다양한 유형의 세포 단백질을 전달할 수 있습니다.
Science, 2023, doi:10.1126/science.adf6249 .
스탠포드 대학의 연구자들은 세포의 변화로 가는 경로 중 하나가 어떻게 작동하는지 밝혀냈습니다. 그 과정에서
노화 관련 질병, 자가면역 질환 , 치료 저항성 암 에 대한 새로운 치료법의 문을 열었습니다.
관련 연구 결과는 'Elucidating the cellular determinants of targeted membrane protein degradation by lysosome-targeting chimeras'이라는 제목으로 사이언스지에 2023년 10월 20일자 게재됐습니다.
이번 새로운 연구에서 논문의 제1저자는 CRISPR 유전자 스크리닝 기술을 사용하여 LYTAC이 단백질을 분해하는 방식을 조절하는 세포 구성 요소를 식별하고 설명했습니다. 연구원들은 세포 단백질을 분해하는 관리 역할을 하는 단백질인 네딜레이티드 컬린 3(CUL3) 수준과 LYTAC 효능 사이의 연관성을 발견했습니다. 둘 사이의 정확한 연관성은 불분명하지만, CUL3이 더 네딜화될수록 LYTAC이 더 효과적입니다.
네딜화된 CUL3의 수준을 측정하면 어떤 환자가 LYTAC 치료에 반응할 가능성이 더 높은지 결정할 수 있습니다. Bertozzi는 이전 연구에서 이러한 상관 관계를 지적한 적이 없었기 때문에 이것이 놀라운 발견이라고 말했습니다.
그들은 또한 LYTAC의 작용을 방해하는 단백질을 발견했습니다. LYTAC은 세포 외부의 특정 수용체에 결합하여 작동하며 이러한 수용체를 사용하여 유해한 단백질을 리소좀으로 전달하여 분해합니다. 그러나 그들은 만노스 6-인산염(M6P)을 함유한 단백질이 이들 수용체에 자리를 잡는다는 사실을 발견했는데, 이는 LYTAC이 이들 수용체에 결합할 수 없음을 의미합니다. M6P 생합성을 방해함으로써 세포 표면의 비어 있는 수용체 수가 증가하고 LYTAC은 이러한 수용체를 탈피할 가능성이 있습니다.
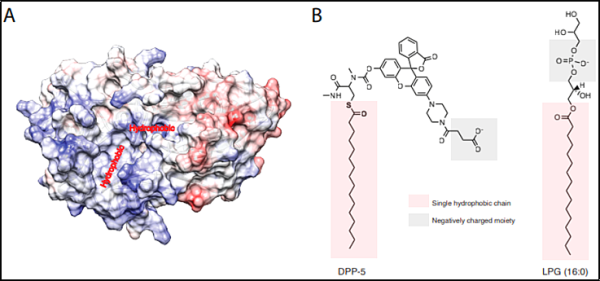
2. Science: CLN5 유전자가 코딩하는 단백질이 BMP 합성효소라는 사실을 밝혀 퇴행성 신경질환의 새로운 치료법 개발로 이어질 수 있습니다
리소좀 단백질의 기능 장애는 다양한 신경퇴행성 질환과 관련이 있습니다. 이러한 단백질을 암호화하는 유전자의 돌연변이가 어떻게 질병을 유발하는지 확인하면 연구원들은 질병에 대해 더 잘 이해할 수 있을 뿐만 아니라 새로운 치료법도 제공할 수 있습니다.
스탠포드대학교 화학공학과 조교수이자 유전학 조교수인 먼터 아부-레마일레(Monter Abu-Remaileh) 연구팀은 희귀하지만 치명적인 신경퇴행성 질환으로 알려진 CLN5라는 리소좀 단백질의 기능을 새로운 연구에서 규명했습니다.
관련 연구 결과가 최근 사이언스(Science) 저널에 게재되었습니다. 논문 제목은 "The Batten disease gene product CLN5 is the lysosomal bis(monoacylglycero)phosphate synthase."입니다.
Science, 2023, doi:10.1126/science.adg9288
그의 연구팀은 이 단백질이 비스(모노아실글리세로)포스페이트(BMP라고도 함)라는 분자 합성에서 핵심 단계를 주도한다는 사실을 발견했습니다. BMP는 알츠하이머병 , 파킨슨병 및 기타 신경퇴행성 질환 에서 중요한 역할을 합니다. 오랫동안 발견하기 힘든 이 단백질을 밝혀내는 것은 과학자들에게 이러한 질병을 치료하기 위한 새로운 약물을 개발할 수 있는 단서를 제공할 뿐만 아니라 세포 생물학에 대한 새로운 패러다임을 확립합니다.
리소좀은 오랫동안 분자 분해의 중심으로 여겨져 왔지만 분자가 제조됩니다.
Abu-Remaileh는 "이제 세포가 BMP를 어떻게 만드는지 알았으므로 이를 활성화하는 방법을 개발할 수 있으며 노화 관련 신경퇴행을 퇴치하고 개선할 수 있는 방법을 찾을 수 있기를 바랍니다"라고 말했습니다.
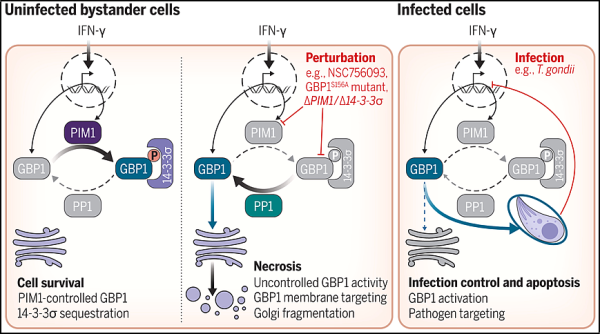
3. Science: 단백질 키나아제 PIM1이 GBP1 단백질 활성을 조절하는 메커니즘을 밝히면 감염성 질환 및 암에 대한 새로운 치료법 개발이 기대됩니다.
GPB1이라는 단백질은 감염된 세포의 미생물을 공격합니다. GBP1은 염증 중에 활성화되며 세포막을 공격하여 손상시킬 가능성이 있습니다. 새로운 연구에서 버밍엄 대학교, 프란시스 크릭 연구소 및 영국의 기타 연구 기관의 연구자들은 항톡소플라즈마 곤디, 클라미디아, 결핵 및 기타 질병 질병 , 심지어 암에 대한 새로운 치료법의 가능성을 제공합니다. 관련 연구 결과가 사이언스 저널에 2023년 10월 6일자 "PIM1 controls GBP1 activity to limit self-damage and to guard against pathogen infection"라는 제목으로 게재되었습니다.
Science, 2023, doi:10.1126/ science.adg2253
연구원들은 세포 내 미생물을 공격하는 단백질이 어떻게 인산화라는 과정을 통해 조절되는지 밝히고 있는데, 이 과정에서 단백질 키나제(Protein Kinase)라는 효소가 단백질에 인산기를 추가하게 됩니다. PIM1이라고 불리는 GBP1을 표적으로 하는 키나아제도 염증 중에 활성화됩니다.
인산화된 GBP1은 다시 비계 단백질에 결합하여 통제되지 않은 GBP1 막 공격과 세포 사멸로부터 감염되지 않은 방관자 세포를 보호합니다. 새로 발견된 자물쇠와 열쇠 메커니즘은 GPB1이 세포막을 무차별적으로 공격하는 것을 방지하여 세포내 병원균에 의한 손상에 민감한 보호 메커니즘을 생성합니다.
논문의 교신저자이자 버밍엄 대학교 선임 연구원인 Eva Frickel 박사는 "이번 발견은 여러 가지 이유로 중요합니다. 첫째, GBP1 제어와 같은 보호 메커니즘은 식물 생물학에 존재하는 것으로 알려져 있지만, 포유류에서는 발견되지 않습니다. GPB1은 나가서 세포막을 공격하려고 하지만 PIM1이 열쇠이므로 GPB1이 안전하게 잠겨 있습니다. 두 번째 그 이유는 이 발견이 다양한 치료 용도를 가질 수 있기 때문입니다. 이제 GBP1이 어떻게 제어되는지 알았으므로 이 기능을 마음대로 켜고 끄는 방법을 탐색하여 병원균을 죽일 수 있습니다."
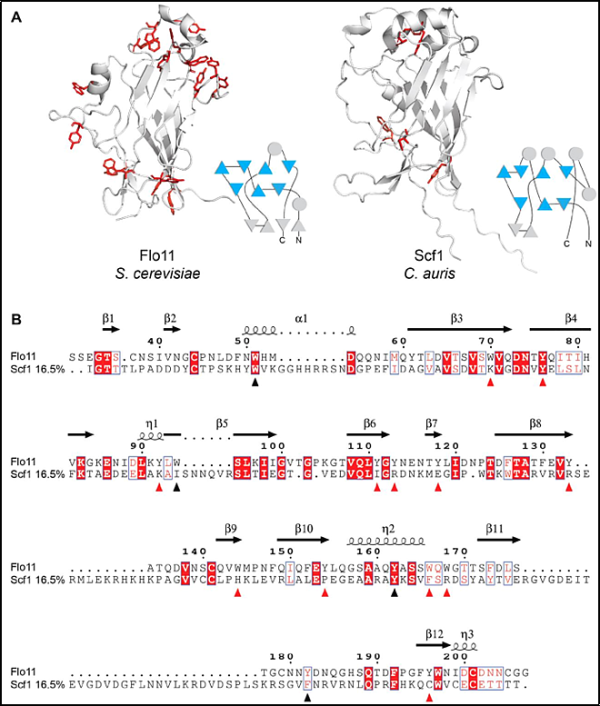
4. Science: 병원성 Candida auris 치료의 중요한 포인트 확인
2009년, 불가사의한 곰팡이가 갑자기 나타나 인류 중 가장 취약한 사람들을 표적으로 삼았습니다. 곰팡이는 매우 실질적인 위협이 됩니다. 연구원들은 생명을 위협하는 곰팡이인 칸디다 아우리스(Candida auris)의 원인이 무엇인지, 병원과 기타 의료 환경에서 최고의 감염 관리 프로그램을 시행해도 왜 이를 근절하지 못하는지 이해하기 위해 시간을 다투고 있습니다.
새로운 연구에서 미시간 대학의 연구자들은 칸디다 아우리스(Candida auris)가 피부부터 카테터까지 모든 것에 달라붙는 놀라운 능력을 연구하고 놀라운 발견을 했습니다. 관련 연구 결과가 최근 사이언스(Science) 저널에 게재되었습니다. 논문 제목은 "A Candida auris-specific adhesin, SCF1, governs surface association, colonization, and virulence"입니다.
논문의 교신 저자인 테레사 오미라(Teresa O'Meara) 박사와 미시간 대학교 의과대학 미생물학 및 면역학과의 대학원생인 다리안 산타나(Darian Santana)가 이끄는 연구팀은 C. auris가 알려진 다른 곰팡이와 다르다는 사실을 발견했습니다. 접착이라는 일종의 단백질을 사용한다는 점에서 따개비나 연체동물과 같은 해양 생물이 사용하는 기능과 매우 유사한 기능을 가진 접착 단백질입니다.
Science, 2023, doi:10.1126/science.adf8972.
그들의 초기 가설은 C. auris가 사용하는 부착체가 Candida albicans와 같은 다른 곰팡이가 사용하는 끈적한 단백질 계열에서 유래했다는 것이었습니다. 그러나 일반적인 용의자인 고도로 보존된 ALS 및 IFF/HYR 단백질 계열을 조사했을 때 부분적인 효과가 있는 IFF4109라는 단백질을 제외하고는 대부분이 누락되었습니다.
(SCF1). 그들은 또한 SCF1이 집락화 증가 및 병원성 강화와 관련이 있음을 발견했습니다. 그들은 연구 모델을 사용하여 SCF1과 IFF4109의 결실이 C. auris 균주가 피부와 유치 요도 카테터에 정착하는 능력을 감소시키는 것을 입증했습니다. 또한 SCF1을 과발현하는 C. auris 균주는 독성이 강화되고 곰팡이 병변이 증가했습니다.
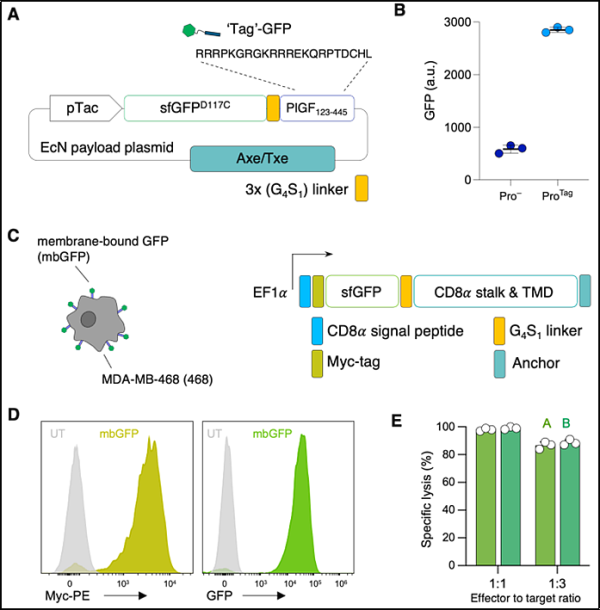
5. Science: CAR-T 세포를 유도하기 위해 유전자 변형 프로바이오틱스를 사용하는 것은 고형 종양 치료를 위한 안전하고 효과적인 보편적인 플랫폼이 될 것으로 기대됩니다.
수년 동안 과학자들은 백혈병 과 림프종 환자를 치료하기 위해 혈액 세포 표면의 특정 항원을 표적으로 삼는 키메라 항원 수용체(CAR) T 세포(CAR-T)를 성공적으로 사용해 왔습니다 . 그러나 유방암 이나 대장암 과 같은 고형 종양을 표적으로 삼기 위해 CAR T 세포를 사용하는 것은 특히 어려운 것으로 입증되었습니다. 고형 종양에는 다양한 항원을 표시하는 다양한 세포가 포함되어 있으며 신체의 건강한 세포도 종종 이러한 항원을 운반합니다. 따라서 일관되고 안전한 종양 표적을 식별하는 것은 개발 첫 단계에서 고형 종양에 대한 대부분의 CAR-T 세포 치료법의 성공을 방해했습니다.
새로운 연구에서 컬럼비아 대학의 연구자들은 종양을 공격하는 새로운 방법을 보고했습니다. 그들은 종양을 집락화할 때 합성 표적을 생성하도록 종양 집락 박테리아(프로바이오틱스)를 설계하여 CAR-T 세포가 합성 표적을 포함하는 이러한 암세포 를 제거하도록 유도했습니다 .
관련 연구 결과는 사이언스 저널에 2023년 10월 13일자 "Probiotic-guided CAR-T cells for solid tumor targeting"라는 제목으로 게재되었습니다.
Science, 2023, doi:10.1126/science.add7034
논문의 교신저자이자 컬럼비아대학교 생의학공학 부교수인 탈 다니노(Tal Danino)는 "우리의 프로바이오틱스 플랫폼은 CAR-T 세포가 여러 유형의 종양을 공격할 수 있게 해준다. 전통적인 CAR-T 세포 치료법은 자연 종양 항원을 표적으로 삼는 데 의존한다"고 말했습니다. 이는 유전자 변형 T 세포와 유전자 변형 박테리아를 결합하여 합성 항원을 고형 종양에 안전하고 체계적이며 효과적으로 전달하는 첫 번째 사례입니다. 이는 많은 암 치료에 큰 영향을 미칠 것입니다."
종양을 찾는 박테리아를 프로그래밍하고 CAR-T 세포가 인식할 수 있는 합성 항원으로 고형 종양을 코팅함으로써 Danino의 연구실은 본질적으로 보편적인 항원을 공격할 수 있는 보편적인 CAR-T 세포를 구축합니다. 이 프로바이오틱스 유도 CAR-T 세포(ProCAR) 플랫폼은 저자들이 유전자 변형 프로바이오틱스와 CAR-T 세포를 성공적으로 결합한 최초의 사례이며, CAR-T 세포가 직접 생산된 합성 항원에 반응한다는 사실을 입증한 최초의 사례이기도 합니다.
논문의 공동 제1저자이자 다니노 연구실의 박사과정 학생인 로사 빈센트(Rosa Vincent)는 “종양 표적 박테리아와 CAR-T 세포를 결합하는 이점은 새로운 종양 인식 전략을 제공하며 이는 유전자 변형 기술을 개발하는 새로운 방법을 제공한다”고 말했습니다. 생체 내 치료를 위한 박테리아 공동체가 기반을 마련했습니다. 우리는 이 두 가지 세포 치료의 가장 좋은 특징, 즉 박테리아를 사용하여 종양 표적을 생성하는 것과 T 세포를 사용하여 악성 종양 각 치료법마다 고유한 한계가 있습니다.”
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.