2024년 4월 T-Cell 연구 발표
페이지 정보
작성자 PnH 조회124회 작성일 24-05-31 07:20본문
1. EMBO Molecular Medicine:Early induction of cytokine release syndrome by rapidly generated CAR T cells in preclinical models
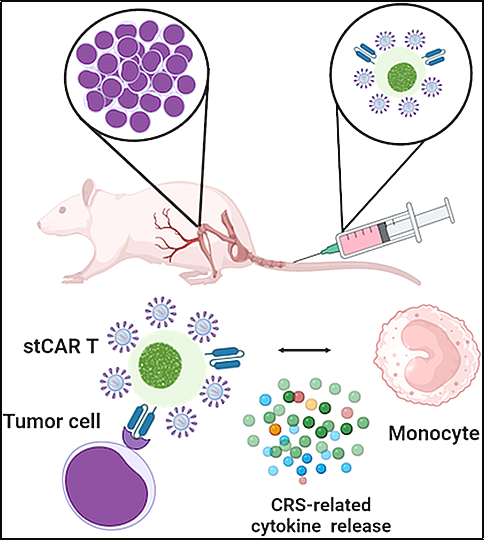
독일 파울엘리히연구소 분자생명공학 및 유전자치료 연구그룹장인 크리스티안 부흐홀츠(Christian Buchholz) 교수 연구팀은 새로운 연구에서 CAR-T 세포의 단기 배양과 관련된 안전성 문제를 해결했습니다. 동물실험 모델과 세포 기반 테스트를 이용해 단기 배양된 CAR-T 세포가 기존 CAR-T 세포에 비해 사이토카인 방출 증후군(CRS) 유발 위험이 유의하게 높다는 사실을 확인했습니다. 관련 연구 결과는 EMBO Molecular Medicine 저널에 "전임상 모델에서 빠르게 생성된 CAR T 세포에 의한 사이토카인 방출 증후군의 조기 유도"라는 제목으로 2024년 3월 21일자 게재되었습니다.
2024, doi:10.1038/s44321-024-00055-9
그들의 연구는 또한 CRS 관련 사이토카인의 방출이 종양 세포의 존재와 무관하다는 것을 보여주었습니다. 대신, 단기 배양된 CAR-T 세포 표면의 렌티바이러스 벡터 입자의 잔류 성분이 원인인 것으로 나타났습니다.
이러한 연구 결과는 단기 배양 CAR-T 세포의 임상 적용 후 CRS 유도에 특별한 주의가 필요하며, 임상 적용 전 이들 세포의 위험성을 평가할 수 있는 직접적인 테스트 시스템을 갖추는 것이 필요함을 강조합니다.
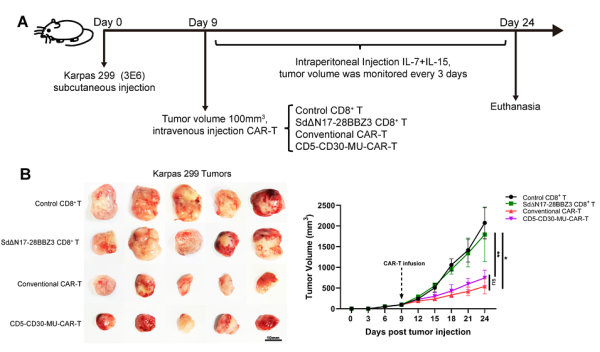
2. EMBO Molecular Medicine:Targeting the mevalonate or Wnt pathways to overcome CAR T-cell resistance in TP53-mutant AML cells
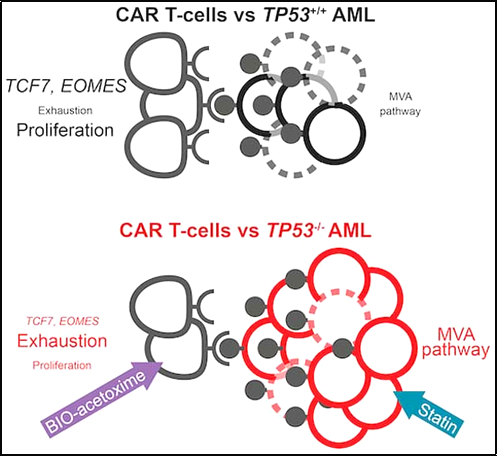
취리히 대학과 스위스 취리히 대학 병원 연구진은 새로운 연구에서 CAR-T 세포 치료 및 기타 치료를 방해하는 공격적인 혈액암의 암세포에 특정 돌연변이가 존재한다는 사실을 발견했습니다. 그들의 연구는 또한 암세포가 저항성을 갖게 되는 이유와 이러한 저항성을 극복할 수 있는 방법, 즉 약물 요법이나 유전자 변형 CAR-T 세포의 동시 사용을 통해 설명합니다. 관련 연구 결과는 EMBO Molecular Medicine 저널에 "Targeting the mevalonate or Wnt paths to 극복 CAR T-cell resistance in TP53-mutant AML cell"이라는 제목으로 2024년 3월 14일자 게재되었습니다.
2024, doi:10.1038/s44321-024-00024-2
취리히 대학과 취리히 대학 병원 종양학 및 혈액학과의 Markus Manz 교수와 Steffen Boettcher 교수가 이끄는 국제 연구팀은 이제 TP53 돌연변이를 보유하는 AML 세포가 CAR T 세포 치료에 훨씬 더 저항성이 있다는 것을 확인했습니다. 면역요법의 종류 이 유전자에 돌연변이가 없는 AML 세포. Boettcher는 "TP53 유전자에 돌연변이가 있는 CAR-T 세포가 덜 효과적인 이유는 이러한 면역 세포가 더 빨리 스스로를 소모하여 암세포에 대해 덜 활동하기 때문입니다."라고 말했습니다.
CAR-T 세포 치료에서는 T 세포로 알려진 특정 면역 세포가 환자의 혈액에서 추출됩니다. 그런 다음 이러한 면역 세포는 실험실에서 유전적으로 변형되어 표면에 키메라 항원 수용체(CAR)로 알려진 많은 새로운 접촉점을 형성합니다. 이러한 CAR-T 세포를 환자의 몸에 다시 주입하면 종양 세포의 특정 표면 구조를 인식할 수 있어 CAR-T 세포가 암세포를 인식하고 표적 방식으로 제거할 수 있습니다. 현재 여러 CAR-T 세포 제품이 초기 단계 임상 시험에서 AML에 대해 테스트되고 있습니다.
3. Blood:Second Primary Malignancies After Commercial CAR T Cell Therapy: Analysis of FDA Adverse Events Reporting System (FAERS)
2024년 3월 14일자 Blood저널에 게재된 "Second Primary Malignancies After Commercial CAR T Cell Therapy: Analysis of FDA Adverse Events Reporting System (FAERS)"라는 제목의 논문에 따르면, 키메라 항원 수용체가 2차 원발성 악성종양으로 인정되었습니다( SPM)은 (CAR) T 세포(CAR-T 세포) 치료 환자가 보고한 부작용 중 극히 일부만을 차지합니다.
하버드 의과대학의 Magdi Elsallab 박사팀은 미국 식품의약국(FDA)의 부작용 보고 시스템 데이터베이스를 분석하여 CAR-T 세포 치료 후 보고된 SPM을 정량적으로 식별했습니다.
저자는 12,394개의 고유한 CAR T 세포 치료 관련 부작용 보고서를 발견했으며, 그 중 2,225개는 시스템 기관 범주 "양성, 악성 및 불특정 종양"과 관련이 있었습니다. 제외 기준을 적용한 후 총 536개의 SPM 보고서(4.3%)가 포함되었습니다. 대부분의 보고서에는 CAR-T 세포 치료제인 axicabtagene ciloleucel과 tisagenlecleucel(각각 51.7% 및 33.0%)이 포함되었습니다. 고급 그룹 용어로 가장 흔한 SPM은 백혈병(62.1%)으로 전체 CAR-T 세포 치료 보고의 2.7%를 차지했으며, 피부 종양(10.1%)이 그 뒤를 이었습니다. 백혈병에는 골수이형성증후군, 급성골수성백혈병, T세포대과립림프구성백혈병이 각각 208예, 106예, 2예가 포함됐습니다.
엘살랩은 성명을 통해 "우리는 CAR-T 세포 치료와 관련된 위험에 대해 더 자세히 알아보기 위해 FDA가 발표한 데이터를 계속 모니터링할 것"이라며 "그러나 승인된 적응증의 경우 CAR-T 세포의 이점을 강조해야 한다"고 말했다. 치료는 여전히 위험보다 더 큽니다."
4. Blood Advances:Impact of diagnostic investigations in the management of CAR T-cell-associated neurotoxicity
CAR-T 세포 치료와 관련된 심각한 신경학적 합병증을 진단하고 관리하는 데 자기공명영상(MRI)과 (LP)가 항상 필요한 것은 아닐 수도 있다는 새로운 연구 결과가 나왔습니다. 이번 연구 결과는 이러한 신경 독성을 관리하는 데 뇌의 전기적 활동을 측정하는 비침습적 검사인 뇌파검사(EEG)의 사용을 더욱 입증했습니다. 관련 연구 결과는 'CAR T 세포 관련 신경 독성 관리에 대한 진단 조사의 영향'이라는 제목으로 Blood Advances 저널에 2024년 3월 19일 게재되었습니다.
논문의 교신저자이자 프랑스 렌 대학병원 혈액학 전문가인 기욤 맨슨(Guillaume Manson) 박사는 “CAR-T 세포 관련 독성 환자를 치료할 때 일반적으로 임상 1상과 2상을 바탕으로 매우 엄격한 가이드라인을 따른다”고 설명했다. 그러나 이러한 지침을 검증할 수 있는 임상적 증거는 거의 없습니다. 요추 천자와 같은 일부 검사는 환자에게 매우 부담스럽고 충격적일 수 있습니다. 여기에서 이러한 중재가 필요한 시기와 이러한 중재가 필요하지 않은 경우를 더 잘 이해하기를 바랍니다. "
5. Molecular Cancer:The construction of modular universal chimeric antigen receptor T (MU-CAR-T)cells by covalent linkage of allogeneic T cells and various antibody fragments
CAR-T(키메라 항원 수용체-T) 세포 치료법은 놀라운 임상적 성공을 거둔 새로운 면역 치료법입니다. 그러나 준비 시간이 길고 비용이 높으며 개인 간 다양성으로 인해 적용이 제한되었습니다. 범용 CAR-T(U-CAR-T) 세포 제조가 크게 개선되었음에도 불구하고 여전히 안정적이고 균일한 세포는 아닙니다.
최근 쑨원대학교 쑨원 의과대학 인간 바이러스학 연구소 연구진은 분자암 저널에 "모듈형 보편적 키메라 항원 수용체 T(MU-CAR-T) 세포의 구축"이라는 제목의 논문을 발표했습니다. 동종 T 세포와 다양한 항체 단편의 공유 결합에 의해", 이 연구는 동종 T 세포가 다양한 항체 단편에 공유 결합으로 연결되어 모듈형 범용 키메라 항원 수용체 T 세포를 구축한다는 것을 밝혔습니다.
이번 연구에서 연구진은 새로운 모듈형 범용 CAR-T(MU-CAR-T) 셀을 구축해 U-CAR-T 셀의 편의성과 유연성을 더욱 향상시키려고 시도했습니다. 이를 위해 연구진은 초기에 건강한 기증자를 선별하고 T 세포를 배양하여 강력한 자기 재생 능력, 지속 가능성 및 세포 독성을 갖춘 줄기 세포 유사 기억 T 세포(TSCM)를 더 높은 비율로 얻었습니다.
동종이형 반응을 줄이기 위해 CRISPR/Cas9 시스템을 사용하여 T 세포 수용체(TCR)와 백혈구 항원 클래스 I(HLAI) 유전자를 이중 녹아웃시켜 T 세포를 추가로 편집했습니다. 잘 자라며 유전적으로 안정적인 보편적인 세포는 안정적이고 통합된 세포로 저장됩니다. 이어서, SDCatcher/GVoptiTag 시스템을 사용하여 이소펩티드 결합을 생성하고, 다양한 항원에 대해 정제된 단일 사슬 항체를 회수된 CAR-T 세포에 공유적으로 연결합니다.
생성된 CAR-T 세포는 인간 면역결핍 바이러스 1형(HIV-1) 잠복 감염 세포를 박멸하거나 T 림프종 세포를 제거하는 등 서로 다른 세포를 표적으로 삼아 다양한 기능을 기존 CAR과 동일한 효율로 수행할 수 있습니다.
6. New England Journal of Medicine:Intraventricular CARv3-TEAM-E T Cells in Recurrent Glioblastoma
치명적인 형태의 뇌암 환자에게 세포 치료법을 제공하기 위한 공동 프로젝트가 새로운 치료법을 받은 최초의 환자에게서 극적인 결과를 달성했습니다. 매사추세츠 종합병원 암센터 연구진은 2024년 3월 13일 뉴잉글랜드 저널 오브 메디신(New England Journal of Medicine)에 온라인으로 게재된 "재발성 교모세포종의 뇌실 내 CARv3-TEAM-E T 세포"라는 제목의 논문에서 교모세포종(GBM) 치료를 위한 CAR-T 세포 치료법을 평가하는 1상 임상 시험결과입니다.
INCIPIENT라고 불리는 임상 시험은 재발성 GBM 환자를 대상으로 CARv3-TEAM-E T 세포의 안전성을 평가하기 위해 설계되었습니다. 단일 치료 후 불과 며칠 만에 환자들은 상당한 종양 축소를 경험했으며, 한 환자는 거의 완전한 종양 퇴행을 경험했습니다. 저자는 시간이 지남에 따라 이들 환자의 종양 진행을 관찰했지만 이 전략의 고무적인 예비 결과를 고려하여 반응의 지속성을 연장하기 위한 여러 전략을 추구할 것입니다.
"이것은 벤치에서 병상까지 이어지는 치료에 대한 이야기입니다."라고 신경외과 및 암센터 뇌종양 면역학 및 면역치료 센터의 세포 면역치료 프로그램 부소장인 신경외과 의사 Bryan Choi는 말했습니다.
매사추세츠 종합병원(Massachusetts General Hospital) 종합병원 연구실은 새로운 세포 치료법을 설계하여 5년 이내에 환자에게 제공함으로써 중요한 요구 사항을 충족시켰습니다. CAR-T 세포 치료 플랫폼은 암 환자 치료에 대한 우리의 생각 방식에 혁명을 일으켰습니다. 그러나 GBM 고형 종양과 마찬가지로 "모든 암세포가 동일하지 않고 종양 내 세포가 다르기 때문에 치료가 여전히 어렵습니다. 우리의 접근 방식은 두 가지 치료 방식을 결합하여 GBM을 더 광범위하고 효과적인 방법으로 치료할 수 있습니다."
7. Cancer Cell:ALK inhibitors increase ALK expression and sensitize neuroblastoma cells to ALK.CAR-T cells.
신경모세포종은 치명적일 수 있으며, 고위험 신경모세포종을 앓는 어린이의 5년 생존율은 50%에 불과합니다. 최근 국제적인 잡지인 Cancer Cell에 "ALK 억제제는 ALK 발현을 증가시키고 신경모세포종을 감작시킨다"라는 제목의 논문이 게재됐다는 연구보고서에서 "Cell to ALK.CAR-T 세포"라는 하버드 의과대학 및 기타 기관의 과학자들은 연구를 통해 CAR-T 세포 치료를 통해 신경모세포종을 더 잘 치료할 수 있는 새로운 방법이 가능하다고 보고했습니다.
연구자들은 이전에 많은 암을 유발하는 것으로 알려진 종양 유전자인 ALK 수용체를 특이적으로 표적으로 하는 CAR-T 세포를 개발했지만, 모든 신경모세포종 환자의 종양 세포가 강력한 CAR-T 세포 공격을 유인할 만큼 충분한 수준의 ALK 수용체를 가지고 있는 것은 아닙니다. 엘리사 베르가지오(Elisa Bergaggio) 연구원은 CAR-T 세포치료제에 ALK 억제제 약물을 추가하려고 시도한 결과, 이 억제제가 ALK 수용체의 발암성 신호를 침묵시킬 뿐만 아니라 세포 표면의 이들 수용체의 양을 증가시켜 이를 발현시키는 것을 발견했다고 밝혔습니다. ALK 발현이 낮은 환자의 경우 CAR-T 세포에 대한 표적이 더 많습니다.
ALK 수용체는 존재하지만 ALK 억제제에 의해 비활성화되며, 비활성 상태로 세포 표면에 남아 있기 때문에 표면 발현이 증가하면 CAR-T 세포의 결합 및 사멸 활성이 촉진됩니다. 연구진이 기사에서 보고한 바와 같이, ALK 표적화 CAR-T 세포와 ALK 억제제의 조합은 생쥐의 전이성 신경모세포종 치료를 위한 잠재적 치료법이 될 수 있으며, 생쥐는 종양 성장을 크게 감소시키고 생존율을 향상시켰습니다.
연구진은 현재 이 치료법의 강화되고 보다 효과적인 버전 2.0을 개발하기 위해 노력하고 있으며, 불응성 또는 재발성 신경모세포종을 앓는 어린이를 대상으로 이 병용 치료법을 테스트하기 위해 FDA에 승인을 신청하고 있으며, 관련 임상시험은 올 봄에 시작될 것으로 예상됩니다. . 재발성 또는 불응성 신경모세포종을 앓고 있는 어린이에게는 먼저 ALK 표적 CAR-T 세포를 증량하여 투여하고, 안전성이 입증되면 각 치료마다 ALK 억제제를 추가하게 됩니다
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.