2024년 Journal of Autoimmunity : CD70 CAR-T 치료 연구 발표
페이지 정보
작성자 PnH 조회116회 작성일 24-07-04 16:21본문
2024년 1월 27일, "Journal of Autoimmunity"에 발표된 연구는 SLE에서 CD70 메틸화의 역할에 초점을 맞췄습니다. 결과는 SLE 환자의 CD4+ T 세포에서 CD70 유전자의 평균 DNA 메틸화 수준이 높고, 메틸화 수준이 연령에 따라 증가하며, 이는 노화 가속화와 관련이 있을 수 있음을 보여줍니다. 이는 발병 기전 및 잠재적 개입에 대한 심층적인 연구를 제공합니다. [1]
최근 보고서에 따르면 연구자들은 면역정보학 기술을 통해 신장 세포 암종에 대한 CD70 단백질 CAR-T를 설계했습니다. 이 치료에는 특정 T 세포 에피토프, 세포 투과성 펩타이드 및 종양 괴사 인자-알파가 포함되어 있습니다. 컴퓨터 시뮬레이션 결과, 이 백신은 우수한 항원성, 안전성, 폭넓은 적용성, 강력한 결합력을 갖고 있으며 B세포와 T세포를 효과적으로 자극할 수 있는 것으로 나타났습니다.
이는 CD70이 종양 면역치료 전략에서 큰 잠재력을 가지고 있음을 보여줍니다 [2] . CD70은 종양괴사인자(TNF) 수용체에 속하며 널리 보고된 T 및 B 세포 면역 보조자극 분자입니다. 많은 연구에서 CD70이 면역 질환 및 종양에서 중요한 역할을 한다는 것이 확인되었으며, 현재 임상 연구의 인기 있는 유망한 표적 입니다.
CD70(종양 괴사 인자 수용체 슈퍼패밀리, TNFSF7, CD27L, CD27LG로도 알려짐)은 종양 괴사 인자 수용체 슈퍼패밀리의 구성원입니다. 이 TNF 수퍼패밀리는 TNFα , 림프톡신, CD30L , CD40L , FasL , OX40L , 4-1BBL , NF-kB 수용체 활성화제( RANKL 와 같은 20개 이상의 막 결합 단백질 리간드 및 분비 단백질 리간드로 구성됩니다. ( APRIL ), B 림프구 자극제( BLyS ), 신경 성장 인자( NGF ) 및 TNF 관련 세포사멸 유도 리간드( TRAIL ).
인간 CD70 유전자는 염색체 19p13에 위치하며 193개의 아미노산으로 구성된 삼량체이며 분자량은 약 50kDa입니다. 구조적으로, CD70은 세포외 결합 영역, 막횡단 영역, 짧은 세포내 서열 및 2개의 N-말단 글리코실화 서열을 포함합니다. 세포외 결합 영역의 155개 아미노산 서열은 접힌 부분에서 TNF 리간드 슈퍼패밀리의 다른 구성원과 상당한 상동성을 갖습니다. 세포막 영역의 첫 번째와 세 번째 시스테인, 두 번째와 네 번째 시스테인은 각각 이황화 결합을 형성하여 CD70의 특정 공간 구조를 유지합니다
CD70은 인간과 생쥐의 흉선 수질 상피 세포(MTEC)와 장 고유판의 특정 비전통적 APC 하위 집단에서 구성적으로 발현됩니다. 또한, CD70은 활성화된 T 세포, B 세포 및 수지상 세포의 표면에서만 일시적으로 발현되는데, 이는 T 세포 및 B 세포 표면의 패턴 인식 수용체(PRRS) 및 항원 수용체에 의해 제어되기 때문에 CD70의 발현이 증가하게 됩니다. 사이토카인 IL-1a , IL-12 , TNF-α, 프로스타글란딘 E2 에 의해 엄격하게 규제되고 CD28 및 CD40 에 의한 공동 자극에 의해 규제됩니다. 상피 세포 및 기타 세포 유형도 악성 형질전환 중에 CD70을 발현할 수 있습니다
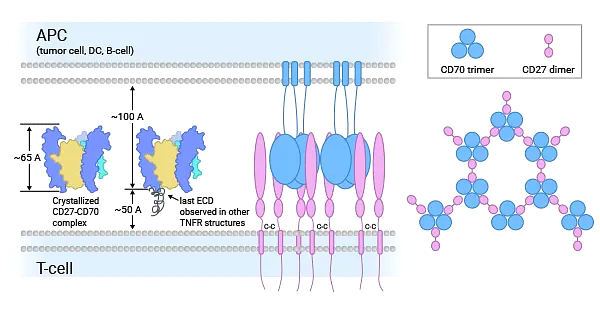
CD70은 유일한 수용체인 CD27에 결합하는 것으로 생각됩니다. CD27은 TNFR 계열의 종양 괴사 인자 수용체(TNFR) 관련 인자 결합 구성원입니다. TNFR 구성원에는 CD30 , CD40 , CD134( OX40 ) 및 CD137 (4-1BB)도 포함됩니다. 이들 수용체는 세포 성장, 분화, 세포사멸 또는 예정된 사망을 조절하는 데 매우 중요한 역할을 합니다. CD27-CD70은 주로 T 및 B 세포에 활성화, 증식, 생존 및 기억 세포 형성과 관련된 공동자극 신호를 제공합니다 [8-10] .
일부 연구에서는 CD27-CD70 공동 자극이 흉선에서 발생하는 Treg 세포를 죽음으로부터 보호하고, 종양 쥐의 비장 및 림프절에서 Treg 수를 증가시키며, T 세포 분화를 촉진할 수 있음을 보여주었습니다. CD27-CD70 신호전달의 상실은 뒷다리 허혈이 있는 마우스 모델에서 측부 순환의 발달을 억제합니다. 동시에 일부 연구에서는 CD27-CD70 공동자극 신호가 CD4+ T 세포 매개 자가면역 질환에 관여한다는 사실이 밝혀졌습니다. 따라서 CD27-CD70 상호작용은 세포 면역 반응을 조절하는 데 중요합니다
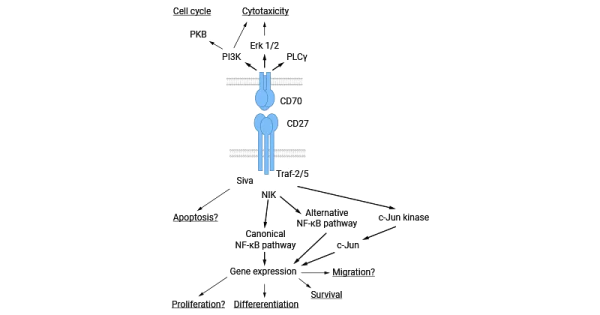
CD70/CD27L/TNFSF7은 CD27의 특정 리간드이며 상호작용할 때 다양한 생물학적 반응을 유발합니다. CD27은 TRAF(예: TRAF2 및 TRAF5 ) 에 결합하여 NF-kB 및 c-Jun 키나제 경로를 활성화하여 세포 증식, 생존 및 분화를 정확하게 조절합니다.
동시에 CD27은 세포사멸 매개체인 Siva 1 에 결합하여 세포 신호 전달 기능을 확장할 수도 있습니다. 연구에 따르면 CD27은 NIK를 통해 NF-kB 경로를 활성화하고 항세포사멸 효과에 참여하며 면역 조절을 위한 복잡하고 정확한 조절 메커니즘을 제공하는 것으로 나타났습니다. CD27을 통한 신호 전달 외에도 일부 연구에서는 CD70 자체가 신호 전달 특성을 가지고 있음을 보여주었습니다.
이들 연구에서는 CD70을 통한 신호전달이 포스포이노시티드-3(PI3) 및 MAP 키나제 경로를 활성화시키는 것으로 보고되었습니다. CD70 신호전달은 일차 B 세포의 세포 주기를 조절하고 동시에 NK 세포, T 세포 수용체(TCR) yδ+ 및 일부 TCRαβ+ T 세포 클론의 세포독성을 유발하는 것으로 나타났습니다( 그림 3 ) [14-15] .
다양한 동물 모델 연구를 통해 과학자들은 T 림프구 기능 조절에서 CD70-CD27 경로의 중요한 역할을 확인했습니다. 이 경로는 바이러스 특이적 CD8+ T 림프구의 효과적인 생존에 중요하며, 활성화된 CD8+ T 림프구에 의해 분비되는 CXCL10 은 CD70-CD27 공동자극에서 화학유인물질 역할도 하며, 이는 또한 이 경로가 면역 세포 사이의 경로를 복잡하게 조절한다는 것을 나타냅니다.
동시에, 연구에 따르면 CD27 신호 전달은 Th1 특이 전사 인자 T-bet을 강화하고 IFN-γ를 분비할 수 있는 Th1 세포 로의 분화를 촉진하는 등 순수 CD4+ T 세포에서 역할을 하는 것으로 나타났습니다. 흑색종에서 T 세포의 입양 전달에 관한 최신 임상 시험에서는 주입된 CD8+ 종양 침윤 림프구에서 CD27 및 CD70의 발현이 항종양 효과와 밀접하게 관련되어 있음을 발견했습니다. 이 발견은 항암 면역요법에서 CD70-CD27 경로의 잠재적인 중요성을 밝힐 뿐만 아니라 면역 조절의 분자 메커니즘에 대한 깊은 이해를 위한 중요한 단서를 제공합니다
B 세포 보조자극 분자인 CD70은 BT 세포 접촉 중에 CD27과 상호작용하여 B 세포의 형질 세포로의 분화를 촉진함으로써 면역글로불린의 생성을 증가시키고 활성화된 자연 살해 세포의 독성 효과를 증가시킵니다. 많은 증거는 CD70이 다양한 유형의 종양(예: 림프종, 고형 종양) 및 자가면역 질환(예: 홍반성 루푸스)에서 발현에 중요한 역할을 한다는 것을 나타냅니다.
다음은 CD70과 종양, 자가면역질환과 관련된 연구를 요약한 것입니다.
혈액학적 악성종양 중 CD70은 호지킨 림프종 및 B 세포 또는 T 세포 유래 림프종에서 흔히 발현됩니다. 또한, CD70은 미만성 거대 B세포 림프종, 여포성 림프종, B림프구 백혈병, 다발성 골수종 및 발덴스트롬 마크로글로불린혈증을 포함하여 B 세포에서 유래된 다른 악성종양에서도 널리 발현됩니다.
한 연구에 따르면 급성 림프구성 백혈병(ALL)을 앓고 있는 어린이의 골수에서 CD27과 CD70의 발현이 크게 상향조절되는 것으로 나타났습니다. 세포 표면에서의 이들의 존재는 백혈병 세포의 증식에 상당한 영향을 미칩니다. 실험에서 항인간 CD70 항체를 사용하여 CD27-CD70 상호작용을 차단한 후 백혈병 세포의 증식이 크게 감소했습니다.
혈액학적 종양 세포에서 CD70의 역할이 완전히 이해되지는 않았지만, 종양 세포에서의 CD70의 발현은 정상 세포의 암화 과정을 반영할 수 있습니다. 따라서 AML을 치료하기 위해 CD70/CD27 신호 전달을 표적으로 삼는 것이 유망한 치료 연구 전략이 될 수 있습니다
고형 종양에서 CD70은 편재적으로 발현되며, 정상 세포에서는 제한된 발현으로 인해 고형 종양을 치료하기 위한 새로운 항체의 유망한 표적이 됩니다. SGN-75는 항CD70 단클론항체와 세포독성 약물인 (Aurisatin)으로 구성된 항체약물접합체(ADC)로 폭넓은 임상적용 가능성을 갖고 있습니다.
Aurisatin은 α-튜블린에 결합하여 튜불린 중합을 방지하는 매우 효과적인 세포독성 약물입니다. 항-CD70 항체 ADC의 세포독성 활성은 엔도솜 경로를 통한 세포 내재화, 세포 미세소관 네트워크의 파괴 및 G2-M 단계 세포 주기의 정지와 관련됩니다. 따라서, CD70을 표적으로 하는 ADC는 종양 세포를 선택적으로 인식하고 내재화할 수 있으며, 종양 세포의 표적화된 사멸을 달성하기 위해 적절한 세포 단위에서 약물을 방출할 수 있습니다
CD70은 전신홍반루푸스(SLE) 환자에서 과발현되고 비정상적인 B 세포 분비 과정과 관련된 B 세포 보조자극 분자입니다. CD70을 억제하는 항체는 비정상적인 B 세포 분비 과정을 차단합니다. 연구에 따르면 Dnmt 억제제 및 ERK 경로 억제제와 같은 많은 DNA 메틸화 억제제가 말초 혈액 CD4+ T 세포 표면에서 CD70의 발현을 증가시킬 수 있는 것으로 나타났습니다.
Dnmt 발현 및 DNA 저메틸화를 특징으로 하는 활동성 홍반성 루푸스 환자의 말초 혈액 CD4+ T 세포 도 CD70을 과발현할 수 있습니다. 홍반성 루푸스 환자의 말초 혈액 CD4+ T 세포에서 RFX1은 히스톤 메틸트랜스퍼라제 SUV39H1 을 동원하여 CD70의 발현을 조절할 수 있습니다. 따라서 CD70 항체는 SLE 치료를 위한 잠재적인 전략이 될 수 있습니다
류마티스 관절염의 발병기전에는 CD4+ T 세포와 MHC 유형 I 양성 항원 제시 세포가 윤활 막 관절에 침투하여 나타나는 면역 체계 조절 장애가 포함됩니다. B 세포는 형질 세포로 분화하고, 면역글로불린을 생성하고, 면역 복합체를 형성하고, 보체를 활성화하고 염증을 유발합니다.
연구에 따르면 CD70은 류마티스 관절염 환자의 CD4+ T 세포 표면에서 발현되며, CD70의 과발현은 CD4+ T 세포 표면의 CD70 발현의 비정상적인 조절과 관련이 있을 수 있습니다. 이러한 비정상적인 조절은 CD28 발현의 상실로 이어질 수 있으며, 이는 결국 T 세포 활성화 후 세포 표면에서 CD70의 지속적인 발현을 유발합니다
전신성 경피증은 면역 장애, 혈관 이상, 장기 결합 조직 섬유증을 특징으로 하는 다기관 자가면역 질환입니다. 전신성 경피증의 원인은 완전히 밝혀지지 않았지만, 유전적 감수성, 환경적 요인, 면역 체계 이상 등이 여러 요인이 복합적으로 작용하여 발생하는 것으로 생각됩니다.
전신 경피증 관련 자가항체에는 항중심절, 항-S170, 항-토포이소머라제 I 및 항-U1-RNP 등이 포함됩니다. 이러한 항체는 면역체계 장애에서 생성됩니다. 연구에 따르면 전신 경피증 환자에서 CD4+ T 세포 표면의 CD70 과발현은 조절 서열의 저메틸화와 관련이 있으며, 이는 CD70이 전신 경피증의 발병에 관여할 수 있음을 시사합니다
다발성 경화증은 중추신경계를 침범하는 면역 관련 염증성 질환으로, 주로 신경 조직에 영향을 미치며, 특히 여성 환자의 경우 더욱 그렇습니다. 질병의 발병기전은 아직 완전히 밝혀지지 않았지만 바이러스 감염 및 면역이상과 관련이 있다. 실험적 자가면역 뇌척수염은 다발성 경화증의 동물 모델로 사용되며, 연구에 따르면 T 세포와 B 세포 사이의 CD70-CD27 상호작용이 항체 생산에 중요한 역할을 하는 것으로 나타났습니다. 항-CD70 항체의 사용은 또한 TNF-α 생산을 조절함으로써 실험적 자가면역 뇌척수염을 억제할 수 있습니다.
요약하면, CD70은 자가면역 질환에서 중요한 역할을 하며 항체 의존성 치료의 잠재적 표적이 되었습니다
신경학적 자가면역 질환의 경우 CD70의 역할에는 두 가지 측면이 있습니다. 한편, CD27-CD70 신호전달 경로를 차단하면 자가면역 뇌척수염의 발병을 억제할 수 있습니다.
전반적으로, CD70 활성화의 시기와 맥락은 신경면역 질환의 발병에 중요한 역할을 하는 것으로 보이며 때로는 질병을 촉진하고 때로는 억제합니다
대규모 유전자 서열 분석 연구를 통해 CD70 리간드 CD27 유전자가 건선에 대한 감수성과 연관되어 있음이 밝혀졌습니다. 이 연구는 또한 면역조직화학을 통해 건선 병변의 T 림프구에서 CD27의 발현이 감소하고 혈장 내 SCD27의 수준도 감소한다는 사실을 발견했습니다. 이러한 발견은 특정한 지침적 중요성을 갖고 있지만, 건선에서 CD27-CD70 경로의 정확한 역할은 여전히 추가 연구가 필요합니다 [35] .
또한, CD70은 염증성 장질환과도 관련이 있습니다. CD70은 장 고유판의 항원 제시 세포(APC)에서 구성적으로 발현되며 장 면역 반응 및 항상성 유지에 참여합니다 [36] . 최근 연구에 따르면 CD70-T 세포는 더 심각한 염증성 장 질환 및 이식편대숙주병을 유발하고 더 많은 염증 인자를 생성하는 것으로 나타났습니다. IFN-γ는 T 세포가 CD70을 발현하도록 유도하고, 조절을 통해 T 세포 증식을 억제하며, 염증성 T 세포의 반응을 제한합니다
현재 단일클론 항체, CAR-T, ADC, CAR-NK, CAR-NKT, 융합 단백질, 수지상 세포 백신, RNA 백신 등 다양한 유형을 포괄하는 53개의 CD70 기반 약물이 개발 중입니다.
단일클론 항체는 CD70을 조절하거나 억제함으로써 종양 세포의 성장과 전이를 방해합니다. ADC는 항체, 링커 및 페이로드의 조합을 통해 CD70 양성 종양 세포에 독성 물질을 전달하고 CD30, 튜불린 및 기타 표적도 표적으로 삼습니다. CAR-T는 변형된 T 세포를 통해 CD70 양성 종양 세포를 인식하고 제거하며 BCMA , CD19 및 기타 표적 에도 효과가 있습니다 .
CAR-NK는 변형된 NK 세포를 이용해 CD70 양성 종양세포를 인식해 공격하며, IL15 , IL15R, TGFβ , CD19 등의 표적에도 효과적 이다. 융합 단백질은 단백질 결합을 통해 CD27, PDL1 , CD70, CD47 , SIRPα 및 기타 표적 의 신호 전달을 조절하거나 억제합니다. 수지상 세포 백신은 면역체계를 활성화하여 CD70, CD19, CD40L 및 기타 표적이 있는 종양 세포에 작용합니다. RNA 백신은 종양 세포를 형질감염시켜 CD70, CD40L 및 TLR4 의 융합 단백질을 발현시켜 면역 반응을 유도합니다.
이들 CD70 관련 약물은 종양 치료, 특히 림프종, 백혈병, 골수종 등 혈액종양 분야에서 주로 사용됩니다.
동시에 이들은 고형 종양(예: 신장 세포 암종, 흑색종, 췌장암) 및 면역 체계 질환(예: 류마티스 관절염, 루푸스) 치료에서도 잠재적인 효능을 보여주었습니다 . Janssen, CRISPR Therapeutics, Ambrx) 및 국내 혁신 제약회사(Pufang Biotech, Linglu Pharmaceutical, Immune Onco)를 비롯해 대학 및 병원(Zhejiang University, Fudan University, MD Anderson Cancer Center)이 있습니다.
따라서 CD70은 종양 및 면역체계 질환 치료에 폭넓은 전망을 제시하고 있으며, 이 분야에 대한 지속적이고 심층적인 연구와 협력을 통해 더욱 혁신적인 연구 솔루션을 제공할 것으로 기대됩니다.
출처입니다
[1] Somers, Emily C., et al. "Associations between CD70 methylation of T cell DNA and age in adults with systemic lupus erythematosus and population controls: The Michigan Lupus Epidemiology & Surveillance (MILES) Program." Journal of Autoimmunity 142 (2024): 103137.
[2] Namdari, Haideh, et al. "Immunoinformatics Approach to Design a Chimeric CD70-Peptide Vaccine against Renal Cell Carcinoma." Journal of Immunology Research 2024 (2024).
[3] Aggarwal, Bharat B., et al. "The role of TNF and its family members in inflammation and cancer: lessons from gene deletion." Current Drug Targets-Inflammation & Allergy 1.4 (2002): 327-341.
[4] Watts, Tania H. "TNF/TNFR family members in costimulation of T cell responses." Annu. Rev. Immunol. 23 (2005): 23-68.
[5] Siegmund, Daniela, and Harald Wajant. "TNF and TNF receptors as therapeutic targets for rheumatic diseases and beyond." Nature Reviews Rheumatology 19.9 (2023): 576-591.
[6] Lubrano di Ricco, Martina, et al. "Tumor necrosis factor receptor family costimulation increases regulatory T‐cell activation and function via NF‐κB." European journal of immunology 50.7 (2020): 972-985.
[7] Dunne, Matthew, et al. "The CD27L and CTP1L endolysins targeting Clostridia contain a built-in trigger and release factor." PLoS pathogens 10.7 (2014): e1004228.
[8] Arroyo Hornero, Rebeca, et al. "CD70 expression determines the therapeutic efficacy of expanded human regulatory T cells." Communications biology 3.1 (2020): 375.
[9] Liu, Weifeng, et al. "Structural delineation and phase-dependent activation of the costimulatory CD27: CD70 complex." Journal of Biological Chemistry 297.4 (2021).
[10] Pandey, Arvind K., et al. "Expression of CD70 modulates nitric oxide and redox status in endothelial cells." Arteriosclerosis, Thrombosis, and Vascular Biology 42.9 (2022): 1169-1185.
[11] Lutfi, Forat, et al. "Targeting the CD27-CD70 pathway to improve outcomes in both checkpoint immunotherapy and allogeneic hematopoietic cell transplantation." Frontiers in Immunology 12 (2021): 715909.
[12] Flieswasser, Tal, et al. "The CD70-CD27 axis in oncology: the new kids on the block." Journal of experimental & clinical cancer research 41.1 (2022): 1-15.
[13] Abolhassani, Hassan. "Specific immune response and cytokine production in CD70 deficiency." Frontiers in Pediatrics 9 (2021): 615724.
[14] Borst, Jannie, Jenny Hendriks, and Yanling Xiao. "CD27 and CD70 in T cell and B cell activation." Current opinion in immunology 17.3 (2005): 275-281.
[15] Denoeud, Julie, and Muriel Moser. "Role of CD27/CD70 pathway of activation in immunity and tolerance." Journal of leukocyte biology 89.2 (2011): 195-203.
[16] Van De Ven, Koen, and Jannie Borst. "Targeting the T-cell co-stimulatory CD27/CD70 pathway in cancer immunotherapy: rationale and potential." Immunotherapy 7.6 (2015): 655-667.
[17] Peperzak, Victor, et al. "CD8+ T cells produce the chemokine CXCL10 in response to CD27/CD70 costimulation to promote generation of the CD8+ effector T cell pool." The Journal of Immunology 191.6 (2013): 3025-3036.
[18] Bowakim-Anta, Natalia, et al. "Chronic CD27-CD70 costimulation promotes type 1-specific polarization of effector Tregs." Frontiers in immunology 14 (2023): 1023064.
[19] Grewal, Iqbal S. "CD70 as a therapeutic target in human malignancies." Expert opinion on therapeutic targets 12.3 (2008): 341-351.
[20] Troeger, A., et al. "Significantly increased CD70 up regulation on TEL-AML positive B cell precursor acute lymphoblastic leukemia cells following CD40 stimulation." Klinische Pädiatrie (2014): 332-337.
[21] Sun, Qian, et al. "P317: ANTI-LEUKEMIA ACTIVITY OF CD70-DIRECTED IMMUNOTHERAPY IN B CELL PRECURSOR ACUTE LYMPHOBLASTIC LEUKEMIA." HemaSphere 7.S3 (2023): e6339407.
[22] Yang, Meijia, et al. "Tandem CAR-T cells targeting CD70 and B7-H3 exhibit potent preclinical activity against multiple solid tumors." Theranostics 10.17 (2020): 7622.
[23] Ryan, M. C., et al. "Targeting pancreatic and ovarian carcinomas using the auristatin-based anti-CD70 antibody–drug conjugate SGN-75." British journal of cancer 103.5 (2010): 676-684.
[24] Barreca, Marilia, et al. "An overview on anti-tubulin agents for the treatment of lymphoma patients." Pharmacology & therapeutics 211 (2020): 107552.
[25] Zhou, Y., et al. "Histone modifications and methyl-CpG-binding domain protein levels at the TNFSF7 (CD70) promoter in SLE CD4+ T cells." Lupus 20.13 (2011): 1365-1371.
[26] Balada, Eva, et al. "Associations between the expression of epigenetically regulated genes and the expression of DNMTs and MBDs in systemic lupus erythematosus." (2012): e45897.
[27] Zhao, Ming, et al. "RFX1 regulates CD70 and CD11a expression in lupus T cells by recruiting the histone methyltransferase SUV39H1." Arthritis research & therapy 12.6 (2010): 1-8.
[28] Nolte, Martijn A., et al. "Timing and tuning of CD27–CD70 interactions: the impact of signal strength in setting the balance between adaptive responses and immunopathology." Immunological reviews 229.1 (2009): 216-231.
[29] O’Neill, Rachel. Essential role of CD27/CD70 pathway in inflammatory T cell response. Diss. faculty of the Graduate School of the University at Buffalo, The State University of New York, 2019.
[30] Jiang, HongYan, et al. "Demethylation of TNFSF7 contributes to CD70 overexpression in CD4+ T cells from patients with systemic sclerosis." Clinical immunology 143.1 (2012): 39-44.
[31] Boutel, Maria Angeliki. Faculty Of Health Sciences. Diss. Aristotle University Of Thessaloniki, 2023.
[32] Dhaeze, Tessa, et al. "CD70 defines a subset of proinflammatory and CNS-pathogenic TH1/TH17 lymphocytes and is overexpressed in multiple sclerosis." Cellular & molecular immunology 16.7 (2019): 652-665.
[33] Lee, Eun Mi, et al. "CD70–CD27 ligation between neural stem cells and CD4+ T cells induces Fas–FasL-mediated T-cell death." Stem cell research & therapy 4.3 (2013): 1-10.
[34] Miller, James, et al. "Soluble CD70: a novel immunotherapeutic agent for experimental glioblastoma." Journal of neurosurgery 113.2 (2010): 280-285.
[35] Boursalian, Tamar E., et al. "Targeting CD70 for human therapeutic use." Therapeutic Targets of the TNF Superfamily (2009): 108-119.
[36] Manocha, Monika, et al. "Blocking CD27-CD70 costimulatory pathway suppresses experimental colitis." The Journal of immunology 183.1 (2009): 270-276.
[37] Leigh, Nicholas D., et al. "Host-derived CD70 suppresses murine graft-versus-host disease by limiting donor T cell expansion and effector function." The Journal of Immunology 199.1 (2017): 336-347.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.